(texto baseado no artigo publicado na Revista Surgical and Experimental Pathology: Tavora et al. in press).
Autores
Emilio Augusto Campos Pereira de Assis1, Fabio Távora 2,3, Felipe D’Almeida Costa 4, Igor Campos da Silva 5, Nicolle Cavalcante Gaglionone 6
1. Introdução
Nos últimos 10 anos, a padronização na preparação, análise e notificação de amostras de câncer de pulmão tornou-se crucial para otimizar os testes moleculares. A Sociedade Brasileira de Patologistas (SBP) formou um grupo de trabalho para avaliar recomendações internacionais, adaptando-as às práticas patológicas nacionais.
Entidades de Apoio ao Estudo:
Sociedade Brasileira de Oncologia Clínica (SBOC)
Sociedade Brasileira de Cirurgiões Torácicos (SBCT)
Grupo Brasileiro de Oncologia Torácica (GBOT)
Objetivo Principal: Melhorar a comunicação com a equipe multidisciplinar (MDT – termo em inglês) para o gerenciamento eficaz dos carcinomas pulmonares.
Nota: A classificação dos tumores pulmonares, subtipos histológicos e nomenclatura OMS não foram abordados neste manual [1–6].
2. Evolução dos Algoritmos de Teste Molecular
Com a aprovação de várias terapias guiadas por biomarcadores para câncer de pulmão, os algoritmos de teste molecular estão em constante evolução. Enquanto este estudo discute algoritmos em foco na prática patológica brasileira, também é enfatizado que novas versões podem ser desenvolvidas conforme as necessidades locais e à luz de novas descobertas.
3. Desafios na Prática Médica Brasileira
Há enormes desafios enfrentados por oncologistas brasileiros relacionados à realização de perfis genômicos:
| Desafios | Descrição |
| Tempo de resposta | Longo período entre análise de amostra e entrega de resultados |
| Acesso a tratamentos | Falta de acesso a tratamentos/ensaios clínicos com base em alterações genômicas detectadas |
| Custo e Reembolso | Custos elevados e falta de sistemas de reembolso |
| Qualidade da amostra | Amostras de baixa qualidade e obstáculos burocráticos na análise molecular |
4. Contextualização de Testes Moleculares em Câncer de Pulmão
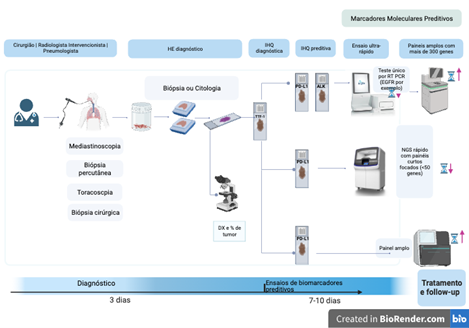
Na maioria dos casos, os testes moleculares são realizados em amostras de biópsia. Isto é atribuído ao fato de que 60-70% dos pacientes são diagnosticados em estágios avançados (IIIB-IV) do câncer. Os princípios que orientam esse processo são fundamentais e consistentes.
Coleta e manejo de tecidos
O diagnóstico patológico no câncer de pulmão vai além da classificação histológica, abrangendo a classificação molecular e o laudo preditivo de biomarcadores. Existem vários métodos para a obtenção de amostras de neoplasias pulmonares malignas. Pequenas amostras(biópsias ou citologia) são cada vez mais comuns, superando os materiais provenientes de ressecção cirúrgica completa. Já que aproximadamente 70% dos pacientes com câncer de pulmão apresentam-se com doença em estágio avançado irressecável, o diagnóstico e a obtenção de biomarcadores dependem principalmente de pequenas biópsias e amostras de citologia. [13, 14, 15]
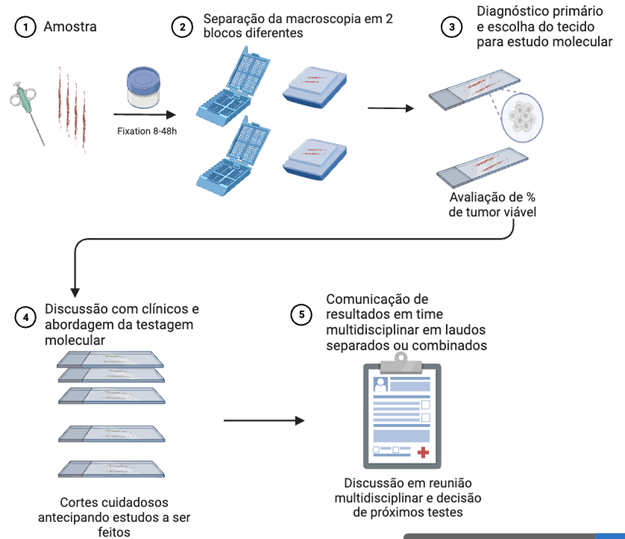
O aumento de amostras pequenas é atribuído aos avanços nas técnicas de imagem e da radiologia intervencionista, aos programas de rastreamento (detecção precoce das lesões), às abordagens cirúrgicas menos invasivas e seguras, e à maior frequência de diagnósticos iniciais de doença inoperável em estágio avançado (principalmente com amostras pequenas). Consequentemente, o manejo dessas pequenas amostras de tumores primários ou metastáticos torna-se ainda mais desafiador, com poucas células neoplásicas viáveis e potencial subamostragem de áreas tumorais heterogêneas (histológica e biologicamente).
A correlação clínico-radiológica é essencial para o manejo de alta qualidade dessas amostras, orientando o diagnóstico histopatológico e, principalmente, a composição do painel imuno-histoquímico. As seguintes características são cruciais:
Informações relevantes necessárias que devem estar nas requisições médicas
| 1. Localização da lesão e características radiológicas da lesão. |
| 2. História clínica do paciente, particularmente a presença de tumores extrapulmonares. |
| 3. Fatores de risco como tabagismo e história familiar de neoplasia. |
| 4. Especificação do método utilizado para aquisição da amostra. |
| 5. O momento exato do procedimento e o tempo em que o tecido foi colocado em formol tamponado a 10%. |
5. O Papel do Patologista na Avaliação da Qualidade Tecidual
O patologista possui uma função vital na avaliação e garantia da qualidade tecidual. As recomendações para essa avaliação e processamento são:
1. Distribuição de Amostras:
Biópsias por agulha ou biópsias transbrônquicas podem ser divididas em blocos distintos durante a macroscopia, de acordo com o número total de fragmentos.
Um bloco para diagnóstico (se IHQ for necessária) e o outro reservado para testes moleculares, assegurando que todos os fragmentos contenham tumor.
2. Seleção de Lâminas:
A lâmina selecionada para análise molecular deve refletir com precisão o diagnóstico do laudo anatomopatológico.
Lâminas sem quantidades significativas de necrose, inflamação ou fibrose devem ser priorizadas.
Em pacientes com várias amostras, deve-se usar o tecido mais recente ou o tecido do foco metastático. Essa escolha deve ser discutida em MDT.
3. Porcentagem de Células Tumorais:
A porcentagem de células tumorais em relação ao total de células nucleadas deve ser registrada e preferencialmente incluída no laudo patológico.
Para análises em laboratórios diferentes, é aconselhável cortar e marcar um H&E adicional.
4. Macrodissecção e Precisão da Análise Molecular:
A macrodissecção é vital para o enriquecimento de células tumorais.
A técnica aperfeiçoa a precisão das análises moleculares.
A quantidade mínima de DNA/RNA tumoral e células malignas necessárias variam conforme o teste molecular.
Processamento da Citologia e Avaliação Rápida no Local (“ROSE”)
A Avaliação Rápida no Local (ROSE) é crucial para garantir a qualidade da amostragem.
1. Recomendação da NCCN:
ROSE é recomendado para assegurar que as amostras de PAAF ou EBUS sejam adequadas para diagnóstico e futuros testes moleculares.
2. Presença de Patologistas:
Requerem-se patologistas no centro cirúrgico ou na sala de broncoscopia para confirmar a adequação do material. Essa disponibilidade deve ser discutida por cada serviço, de acordo com o tipo de reembolso ao laboratório e ao patologista.
3. Benefícios do ROSE:
Garante a adequação da amostra.
Aumenta a taxa de sucesso da amostragem.
Reduz o número de aspirações necessárias.
4. Considerações sobre o ROSE:
Pode ser oneroso e frequentemente possui reembolso limitado.
Pode ser um procedimento demorado.
Tabela de Recomendações para Avaliação e Processamento Tecidual:
| Etapa | Recomendação |
| Distribuição de Amostras | Separar em blocos distintos: bloco para diagnóstico e para testes moleculares. |
| Seleção de Lâminas | Lâmina que reflete o laudo anatomopatológico; evitar lâminas com necrose, inflamação ou fibrose. |
| Porcentagem de Células Tumorais | Registrar e incluir no laudo; cortar H&E adicional se necessário. |
| Macrodissecção | Usar para enriquecer porcentagem de células tumorais; considerar a quantidade mínima para o teste., dependendo da sensibilidade analítica |
| Avaliação Rápida no Local (ROSE) | Seguir recomendações da NCCN; presença de patologistas essencial; considerar benefícios e custos. |
Fontes: [20-30]
Recomendações para aquisição e processamento de amostras de biópsia/citologia. Estes devem ser discutidos em cada instituição e modificados pela patologia de acordo com as práticas atuais. Adaptado de Roy Choudhuri et al., Lindeman et al e Aisner et al.
| Recomendação | Comentário | |
| Agulha | · 14-20G para biópsias com agulha grossa
· 20-25G para FNA · 19-20-21G para EBUS |
|
| Número de fragmento | · Mínimo de 3 biópsias com agulha grossa
· EBUS – 3 a 5 passes · Múltiplas passagens para PAAF transtorácica |
O ROSE pode ser realizado se o patologista e a equipe clínica tiverem protocolos estabelecidos. Caso contrário, o tecido deve ser maximizado em preparações de blocos celulares. |
| Tempo para fixação | Isquemia fria inferior a 1 hora | |
| Fixador | 10% de formalina tamponada neutra | Protocolos de descalcificação com EDTA podem ser usados se necessário. A descalcificação com ácidos não é recomendada. |
| Fixação | 6-48h | O tempo que a amostra foi colocada em formol deve ser informado no pedido. |
| Blocos teciduais | As amostras devem ser idealmente separadas em mais de 1 bloco para processamento e corte | |
| Seleção tecidual para análises moleculares e IHQ | Os patologistas devem escolher o bloco com quantidade máxima de % tumoral e registrar no laudo | A % do tecido pode ser enriquecida por macro ou microdissecção. |
6. Diagnóstico e subtipagem do tumor
Importância do papel do patologista cirúrgico: Este é responsável pelo diagnóstico e subtipagem do tumor, mesmo que isso não seja o foco principal deste guia. Interpretar corretamente o tumor ajuda a preservar o tecido para futuras investigações moleculares.[31]
Diferenciação de tumores: Identificar a malignidade e diferenciar entre carcinoma e outros tipos, como o câncer de células não pequenas, geralmente requer apenas uma coloração H&E. A possibilidade de diferenciação neuroendócrina e se é um câncer primário de pulmão também são considerações importantes.[32, 33] [13, 32, 34, 35]
Estratégias de amostragem: Em uma era de terapias moleculares personalizadas, a amostragem de tecidos é desafiadora. Uma amostra menor provavelmente não representará a heterogeneidade do tumor, e a colaboração multidisciplinar é crucial. Técnicas auxiliares podem ser usadas, visando preservar a amostra para testes moleculares.[36, 37]
Painéis de anticorpos: A investigação com grandes painéis usando mais de 2-4 anticorpos não é recomendada. Em vez disso, um painel limitado é frequentemente suficiente. Laboratórios específicos podem preparar lâminas adicionais para vários testes, embora a maioria no Brasil necessite de blocos de parafina para exames de NGS.[36, 37]
7. Teste do PD-L1
Disponibilidade e relevância: Muitos laboratórios brasileiros só têm a técnica de IHQ. O teste PD-L1, baseado em IHQ, é o único teste preditivo validado para este marcador, mas sua variedade pode causar confusão.[38] [39–41]
Clones de PD-L1: Vários clones de PD-L1 são usados em laboratórios de patologia, incluindo 22C3, 28-8, SP263, e SP142. Eles têm características de desempenho distintas e são otimizados para diferentes propósitos, levando a variações nos resultados.[39, 41–43] [44, 45] [45]
Seleção de amostras: A seleção de amostras adequadas é vital, especialmente se vários blocos teciduais estiverem disponíveis. Técnicas em alguns laboratórios podem exigir cortes adicionais, e, neste caso, os resultados de todos os blocos analisados devem ser combinados.[38]
Amostras de “cell block”: Se o único material disponível for um “cell block”, o PD-L1 pode ser feito, desde que os espécimes citológicos tenham sido processados corretamente com as mesmas características pré-analíticas das biópsias. .[46, 47]
O diagnóstico e subtipagem de tumores desempenham um papel crucial no planejamento do tratamento e na determinação da melhor abordagem para testes moleculares. O PD-L1, em particular, tem várias nuances que os profissionais de saúde precisam considerar ao interpretar os resultados e decidir sobre o tratamento subsequente.
| Pontos Principais | |
| Diagnóstico e Subtipagem do Tumor | • Importância do papel do patologista cirúrgico.<br>• Uso de coloração H&E para diferenciação de tumores.<br>• Desafios na amostragem de tecidos na era das terapias moleculares personalizadas.<br>• Recomendação contra o uso de grandes painéis de anticorpos e preferência por painéis limitados.<br>• Necessidade de blocos de parafina para exames de NGS em muitos laboratórios brasileiros. |
| Teste PD-L1 | • Apenas esta técnica de IHQ está disponível em muitos laboratórios brasileiros |
| • Variedade de testes e de interpretações de PD-L1 pode causar confusão. | |
| • Diferentes clones de PD-L1 utilizados e suas características | |
| • Importância da seleção adequada de amostras e combinação de resultados de vários blocos. | |
| • Uso do teste PD-L1 em “cell block” e requisitos para processamento correto. |
8. Laudos
A Sociedade destaca o importante papel do patologista em todas as fases de relato do diagnóstico e dos achados de biomarcadores no câncer de pulmão. Relatórios precisos e claros são essenciais para uma decisão oportuna, idealmente antes de qualquer tratamento ter sido iniciado. Embora existam muitas diferenças regionais, um cronograma de 10 dias desde a biópsia inicial até o diagnóstico e o relato de biomarcadores é considerado aceitável atualmente. No Brasil, em particular, como os blocos teciduais viajam frequentemente para encaminhamento molecular fora dos estados, é importante que, desde o primeiro laudo diagnóstico até o laudo molecular complementar, informações que indiquem claramente qual bloco, celularidade, presença de necrose e fibrose, necessidade de microdissecção e qualidade da amostra possam comprometer o resultado do exame. A Tabela abaixo resume as diretrizes da ESMO e da PAC. Essas recomendações também seguem o Controle de Qualidade Laboratorial Brasileiro – PACQ ( https://pacq.sbp.org.br/)
Recomendações sobre os principais aspectos da análise e elaboração de laudos
| Categoria | Principais recomendações | Considerações adicionais |
| Laudo diagnóstico | · Indique claramente o diagnóstico final e a necessidade de IHQ adicional. | Os resultados devem ser idealmente discutidos na reunião do conselho da MDT. |
| · Indicar claramente o melhor bloco para estudos moleculares, e a porcentagem de tumor nesse bloco, com uma estimativa aproximada do volume tumoral se escasso. | ||
| · Comentário sobre a qualidade e adequação da amostra | ||
| · Siga as diretrizes locais para indicar quais testes são recomendados e se o encaminhamento é necessário. | ||
| · Os testes para biomarcadores obrigatórios para o tratamento inicial do CPNPC devem ser concluídos dentro de 10 dias úteis. | ||
| Tipos de testes | · Quando vários genes vão ser testados, a NGS é mais custo-efetiva. | Nos avanços do CPNPC, a combinação de RNA/DNA NGS com imuno-histoquímica PD-L1 é provavelmente o cenário ideal, se disponível e se o custo for coberto. |
| · A detecção de PD-L1 deve ser realizada por IHQ | ||
| · O teste de gene único pode ser realizado por RT-PCR | ||
| · ALK por IHQ pode ser realizada para avaliar o estado de fusão de ALK | ||
| · NTRK e ROS1 por IHQ podem ser usados como triagem, mas precisam ser confirmados por métodos adicionais | ||
| · Para fusões RET, a IHQ não é recomendada |
9. Painéis limitados ou expandidos
Diante do cenário brasileiro, observa-se um déficit de dados robustos validando a implementação universal de testagem via Sequenciamento de Nova Geração (NGS) para carcinoma pulmonar. A indicação de testes moleculares necessita ser fundamentada por evidências contemporâneas e resultados potencialmente terapêuticos acionáveis.
Os patologistas têm protagonismo nas discussões da equipe multidisciplinar tumoral (MDT), elucidando as modalidades disponíveis e efetuando uma avaliação individualizada, considerando parâmetros como viabilidade tecidual, volume e percentual de células neoplásicas. Também é atribuição do patologista interpretar os resultados dos testes e determinar a técnica mais pertinente para cada biomarcador.
Recomenda-se a investigação de PD-L1 via Imuno-histoquímica (IHQ), EGFR via RT-PCR ou NGS e ALK por IHQ ou como parte de um painel de NGS em carcinomas pulmonares não pequenas células (CPNPC) estádios I-III, sob indicação de terapia sistêmica.
Além disso, o fluxo diagnóstico no Brasil frequentemente integra múltiplas unidades laboratoriais. Otimizar o rendimento tecidual e minimizar o tempo de retorno são imperativos em tal complexidade.
Há divergência nas práticas moleculares devido à disponibilidade de agentes terapêuticos alvo-específicos e sistemas de saúde. A Sociedade Brasileira de Patologia (SBP) advoga pelo papel de liderança dos patologistas nas MDTs, estabelecendo protocolos de testes. Diretrizes globalmente reconhecem a necessidade de investigação de EGFR, ALK, e PD-L1. Biomarcadores como BRAF, ROS1, NTRK, KRAS, MET, RET e ERBB2 (HER2) são geralmente incluídos em painéis de NGS em etapas subsequentes.
Por fim, a implementação efetiva dos testes moleculares está intrinsicamente atrelada à logística laboratorial e aspectos de remuneração dos exames. No cenário brasileiro, ainda não há reembolso estabelecido para NGS em ambientes públicos ou segurados até a data desta publicação.
10. Referências
Penault-Llorca F, Kerr KM, Garrido P, Thunnissen E, Dequeker E, Normanno N, et al. Expert opinion on NSCLC small specimen biomarker testing – Part 1: Tissue collection and management. Virchows Arch. 2022;481:335–50.
- Penault-Llorca F, Kerr KM, Garrido P, Thunnissen E, Dequeker E, Normanno N, et al. Expert opinion on NSCLC small specimen biomarker testing – Part 2: Analysis, reporting, and quality assessment. Virchows Arch. 2022;481:351–66.
- Dietel M, Bubendorf L, Dingemans A-MC, Dooms C, Elmberger G, García RC, et al. Diagnostic procedures for non-small-cell lung cancer (NSCLC): recommendations of the European Expert Group. Thorax. 2016;71:177–84.
- Lindeman NI, Cagle PT, Aisner DL, Arcila ME, Beasley MB, Bernicker EH, et al. Updated Molecular Testing Guideline for the Selection of Lung Cancer Patients for Treatment With Targeted Tyrosine Kinase Inhibitors. The Journal of Molecular Diagnostics. 2018;20:129–59.
- Lindeman NI, Cagle PT, Aisner DL, Arcila ME, Beasley MB, Bernicker EH, et al. Updated Molecular Testing Guideline for the Selection of Lung Cancer Patients for Treatment With Targeted Tyrosine Kinase Inhibitors: Guideline From the College of American Pathologists, the International Association for the Study of Lung Cancer, and the . Archives of Pathology & Laboratory Medicine. 2018;142:321–46.
- John A, Yang B, Shah R. Clinical Impact of Adherence to NCCN Guidelines for Biomarker Testing and First-Line Treatment in Advanced Non-Small Cell Lung Cancer (aNSCLC) Using Real-World Electronic Health Record Data. Adv Ther. 2021;38:1552–66.
- Fares AF, Martinez PH, Farina PH, Bicalho de Souza I, Araújo D V., Paiva NS, et al. Assessing Oncologists’ Attitudes Concerning Comprehensive Genomic Profiling in Stage IV Lung Adenocarcinoma in Brazil. JTO Clin Res Rep. 2022;3:100402.
- Passaro A, Leighl N, Blackhall F, Popat S, Kerr K, Ahn MJ, et al. ESMO expert consensus statements on the management of EGFR mutant non-small-cell lung cancer. Annals of Oncology. 2022;33:466–87.
- Mosele F, Remon J, Mateo J, Westphalen CB, Barlesi F, Lolkema MP, et al. Recommendations for the use of next-generation sequencing (NGS) for patients with metastatic cancers: a report from the ESMO Precision Medicine Working Group. Annals of Oncology. 2020;31:1491–505.
- Kalemkerian GP, Narula N, Kennedy EB. Molecular Testing Guideline for the Selection of Lung Cancer Patients for Treatment With Targeted Tyrosine Kinase Inhibitors: American Society of Clinical Oncology Endorsement Summary of the College of American Pathologists/International Association for t. J Oncol Pract. 2018;14:323–7.
- Smeltzer MP, Wynes MW, Lantuejoul S, Soo R, Ramalingam SS, Varella-Garcia M, et al. The International Association for the Study of Lung Cancer Global Survey on Molecular Testing in Lung Cancer. Journal of Thoracic Oncology. 2020;15:1434–48.
- Lynette M. Sholl, Wendy A. Cooper, Keith M. Kerr, Daniel SW Tan, Ming-Sound Tsao, James Chih-Hsin Yang. IASLC ATLAS of MOLECULAR TESTING for TARGETED THERAPY in LUNG CANCER. Denver: IALSC; 2023.
- Bubendorf L, Lantuejoul S, de Langen AJ, Thunnissen E. Nonsmall cell lung carcinoma: diagnostic difficulties in small biopsies and cytological specimens: Number 2 in the Series “Pathology for the clinician” Edited by Peter Dorfmüller and Alberto Cavazza. Eur Respir Rev. 2017;26:170007.
- Gill RR, Murphy DJ, Kravets S, Sholl LM, Janne PA, Johnson BE. Success of genomic profiling of non-small cell lung cancer biopsies obtained by trans-thoracic percutaneous needle biopsy. J Surg Oncol. 2018;118:1170–7.
- Hess LM, Krein PM, Haldane D, Han Y, Sireci AN. Biomarker Testing for Patients With Advanced/Metastatic Nonsquamous NSCLC in the United States of America, 2015 to 2021. JTO Clin Res Rep. 2022;3:100336.
- Roy-Chowdhuri S, Dacic S, Ghofrani M, Illei PB, Layfield LJ, Lee C, et al. Collection and Handling of Thoracic Small Biopsy and Cytology Specimens for Ancillary Studies: Guideline From the College of American Pathologists in Collaboration With the American College of Chest Physicians, Association for Molecular Pathology, American Society of Cytopathology, American Thoracic Society, Pulmonary Pathology Society, Papanicolaou Society of Cytopathology, Society of Interventional Radiology, and Society of Thoracic Radiology. Arch Pathol Lab Med. 2020;144:933–58.
- Aisner DL. The Revised College of American Pathologists/International Association for the Study of Lung Cancer/Association for Molecular Pathology Guideline: A Step Forward for Molecular Cytopathology. Archives of Pathology & Laboratory Medicine. 2018;142:684–5.
- Lindeman NI, Cagle PT, Aisner DL, Arcila ME, Beasley MB, Bernicker EH, et al. Updated Molecular Testing Guideline for the Selection of Lung Cancer Patients for Treatment With Targeted Tyrosine Kinase Inhibitors. The Journal of Molecular Diagnostics. 2018;20:129–59.
- Zhong Q, Wagner U, Kurt H, Molinari F, Cathomas G, Komminoth P, et al. Multi-laboratory proficiency testing of clinical cancer genomic profiling by next-generation sequencing. Pathol Res Pract. 2018;214:957–63.
- Russo A, Incorvaia L, Capoluongo E, Tagliaferri P, Galvano A, Del Re M, et al. The challenge of the Molecular Tumor Board empowerment in clinical oncology practice: A Position Paper on behalf of the AIOM- SIAPEC/IAP-SIBioC-SIC-SIF-SIGU-SIRM Italian Scientific Societies. Crit Rev Oncol Hematol. 2022;169:103567.
- Gullo I, Marques A, Pinto R, Cirnes L, Schmitt F. Morphological control for molecular testing: a practical approach. J Clin Pathol. 2020;74:331–3.
- Pei Z, Cao S, Lu L, Chen W. Direct Cellularity Estimation on Breast Cancer Histopathology Images Using Transfer Learning. Comput Math Methods Med. 2019;2019:3041250.
- Cree IA, Deans Z, Ligtenberg MJL, Normanno N, Edsjö A, Rouleau E, et al. Guidance for laboratories performing molecular pathology for cancer patients. J Clin Pathol. 2014;67:923–31.
- Penault-Llorca F, Kerr KM, Garrido P, Thunnissen E, Dequeker E, Normanno N, et al. Expert opinion on NSCLC small specimen biomarker testing — Part 2: Analysis, reporting, and quality assessment. Virchows Archiv. 2022;481:351–66.
- Dufraing K, van Krieken JH, De Hertogh G, Hoefler G, Oniscu A, Kuhlmann TP, et al. Neoplastic cell percentage estimation in tissue samples for molecular oncology: recommendations from a modified Delphi study. Histopathology. 2019;75:312–9.
- Fassina A, Corradin M, Zardo D, Cappellesso R, Corbetti F, Fassan M. Role and accuracy of rapid on-site evaluation of CT-guided fine needle aspiration cytology of lung nodules. Cytopathology. 2010;22:306–12.
- Jain D, Allen TC, Aisner DL, Beasley MB, Cagle PT, Capelozzi VL, et al. Rapid On-Site Evaluation of Endobronchial Ultrasound–Guided Transbronchial Needle Aspirations for the Diagnosis of Lung Cancer: A Perspective From Members of the Pulmonary Pathology Society. Archives of Pathology & Laboratory Medicine. 2017;142:253–62.
- Sung S, Heymann JJ, Crapanzano JP, Moreira AL, Shu C, Bulman WA, et al. Lung cancer cytology and small biopsy specimens: diagnosis, predictive biomarker testing, acquisition, triage, and management. J Am Soc Cytopathol. 2020;9:332–45.
- Fox AH, Jett JR, Roy UB, Johnson BE, King JC, Martin N, et al. Knowledge and Practice Patterns Among Pulmonologists for Molecular Biomarker Testing in Advanced Non-small Cell Lung Cancer. Chest. 2021;160:2293–303.
- Botticella MA, De Summa S, Cisternino L, Tommasi S, Pastena MI, Schirosi L, et al. The role of rapid on site evaluation on touch imprint cytology and brushing during conventional bronchoscopy. Diagn Cytopathol. 2021;49:832–7.
- WHO Classification of Tumours Editorial Board, editor. Thoracic Tumours: WHO Classification of Tumours. 5th edition. Lyon: IARC; 2021.
- Loo PS, Thomas SC, Nicolson MC, Fyfe MN, Kerr KM. Subtyping of Undifferentiated Non-small Cell Carcinomas in Bronchial Biopsy Specimens. Journal of Thoracic Oncology. 2010;5:442–7.
- De Oliveira ACSM, Da Silva AVA, Alves M, Cronemberger E, Carneiro BA, Melo JC, et al. Molecular profile of non-small cell lung cancer in northeastern Brazil. Jornal Brasileiro de Pneumologia. 2019;45.
- Edwards SL. Preoperative histological classification of primary lung cancer: accuracy of diagnosis and use of the non-small cell category. J Clin Pathol. 2000;53:537–40.
- Thunnissen E. How to Validate Predictive Immunohistochemistry Testing in Pathology? A Practical Approach Exploiting the Heterogeneity of Programmed Death Ligand-1 Present in Non–Small Cell Lung Cancer. Archives of Pathology & Laboratory Medicine. 2018;143:11–2.
- Aggarwal C, Bubendorf L, Cooper WA, Illei P, Borralho Nunes P, Ong B-H, et al. Molecular testing in stage I–III non-small cell lung cancer: Approaches and challenges. Lung Cancer. 2021;162:42–53.
- Yatabe Y, Dacic S, Borczuk AC, Warth A, Russell PA, Lantuejoul S, et al. Best Practices Recommendations for Diagnostic Immunohistochemistry in Lung Cancer. J Thorac Oncol. 2019;14:377–407.
- Cheung CC, Barnes P, Bigras G, Boerner S, Butany J, Calabrese F, et al. Fit-For-Purpose PD-L1 Biomarker Testing For Patient Selection in Immuno-Oncology: Guidelines For Clinical Laboratories From the Canadian Association of Pathologists-Association Canadienne Des Pathologistes (CAP-ACP). Appl Immunohistochem Mol Morphol. 2019;27:699–714.
- Tsao MS, Kerr KM, Kockx M, Beasley M-B, Borczuk AC, Botling J, et al. PD-L1 Immunohistochemistry Comparability Study in Real-Life Clinical Samples: Results of Blueprint Phase 2 Project. J Thorac Oncol. 2018;13:1302–11.
- Forde PM, Chaft JE, Smith KN, Anagnostou V, Cottrell TR, Hellmann MD, et al. Neoadjuvant PD-1 Blockade in Resectable Lung Cancer. N Engl J Med. 2018;378:1976–86.
- Hirsch FR, McElhinny A, Stanforth D, Ranger-Moore J, Jansson M, Kulangara K, et al. PD-L1 Immunohistochemistry Assays for Lung Cancer: Results from Phase 1 of the Blueprint PD-L1 IHC Assay Comparison Project. Journal of Thoracic Oncology. 2017;12:208–22.
- Vennapusa B, Baker B, Kowanetz M, Boone J, Menzl I, Bruey J-M, et al. Development of a PD-L1 Complementary Diagnostic Immunohistochemistry Assay (SP142) for Atezolizumab. Appl Immunohistochem Mol Morphol. 2019;27:92–100.
- Rimm DL, Han G, Taube JM, Yi ES, Bridge JA, Flieder DB, et al. A Prospective, Multi-institutional, Pathologist-Based Assessment of 4 Immunohistochemistry Assays for PD-L1 Expression in Non-Small Cell Lung Cancer. JAMA Oncol. 2017;3:1051–8.
- Dodson A, Parry S, Lissenberg-Witte B, Haragan A, Allen D, O’Grady A, et al. External quality assessment demonstrates that PD-L1 22C3 and SP263 assays are systematically different. J Pathol Clin Res. 2020;6:138–45.
- Krawczyk P, Jarosz B, Kucharczyk T, Grenda A, Reszka K, Pankowski J, et al. Immunohistochemical assays incorporating SP142 and 22C3 monoclonal antibodies for detection of PD-L1 expression in NSCLC patients with known status ofEGFRandALKgenes. Oncotarget. 2017;8:64283–93.
- Rekhtman N, Roy-Chowdhuri S. Cytology Specimens: A Goldmine for Molecular Testing. Archives of Pathology & Laboratory Medicine. 2016;140:1189–90.
- Wang H, Agulnik J, Kasymjanova G, Wang A, Jiménez P, Cohen V, et al. Cytology cell blocks are suitable for immunohistochemical testing for PD-L1 in lung cancer. Annals of Oncology. 2018;29:1417–22.
- Aggarwal C, West H (Jack). Molecular Marker Testing in Curable Non–Small Cell Lung Cancer—Practice Necessarily Precedes Data. JAMA Oncol. 2023. https://doi.org/10.1001/jamaoncol.2023.0251.
Link: https://surgexppathol.biomedcentral.com/articles/10.1186/s42047-023-00138-w
Guidelines for molecular testing in non-small cell lung cancer – recommendations from the Brazilian Society of Pathology
Autores
Emilio Augusto Campos Pereira de Assis1, Fabio Távora 2,3, Felipe D’Almeida Costa 4, Igor Campos da Silva 5, Nicolle Cavalcante Gaglionone 6
1 CIDAP, Laboratório de Patologia, Juiz de Fora, Brasil
2 Argos, Laboratório de Patologia, Fortaleza, Brasil
3 Universidade Federal do Ceará, Fortaleza, Brasil
4 Departamento de Anatomia Patológica, A.C.Camargo Cancer Center, São Paulo, Brasil
5 Departamento de Patologia, Rede D’Or, Salvador, Brasil
6 Departamento de Anatomia Patológica, A.C.Camargo Cancer Center, Rio de Janeiro, Brasil
