Autores
José Cândido Caldeira Xavier Junior4,5, Karina Munhoz de Paula Alves Coelho1, Mariana Petaccia de Macedo3, Robledo Fonseca Rocha2,6, Rute Facchini Lellis3,7
Tumores melanocíticos
1. Termos da dermatoscopia
1.1 Termos dermatoscópicos mais comumente utilizados que sugerem benignidade nas lesões melanocíticas
- Padrão homogêneo. Área preferencialmente monocromática, ou com mais de uma cor simetricamente distribuídas, desprovida dos elementos dermatoscópicos básicos, ou na qual esses elementos são escassos demais para formar um padrão.
- Padrão globular regular (quando predominante), incluindo cobblestone. Comumente observado em nevos congênitos, indica a presença de ninhos melanocíticos intradérmicos regularmente distribuídos e com tamanho e formato semelhantes. Os ninhos podem ser maiores e mais compactados, aparentando o encaixe em mosaico das pedras em calçadas portuguesas (padrão cobblestone).
- Rede pigmentar regular. Rede de linhas equidistantes com espessura e coloração uniformes formadas por hiperpigmentação das cristas epidérmicas devido à presença de ninhos melanocíticos juncionais. As áreas normopigmentadas delimitadas pelas linhas correspondem à epiderme suprapapilar desprovida de ninhos. Tipicamente encontrada em nevos melanocíticos adquiridos.
- Sulcos paralelos (nas lesões melanocíticas acrais). Indica proliferação melanocítica nas cristas profundas limitantes da epiderme, que se projeta em colunas pigmentadas para os sulcos dermatoglíficos (Fig. 1).
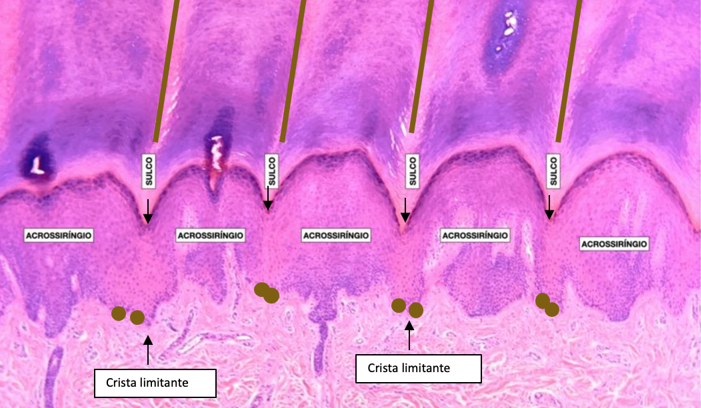
Fig. 1. Características microscópicas (H&E) da pele em região acral, com esquema representativo de proliferação melanocítica benigna nas cristas limitantes, correspondente ao aspecto clínico benigno de pigmentação na camada córnea com distribuição nos sulcos, formando linhas paralelas.
1.2 Termos dermatoscópicos mais comumente utilizados de alerta (possíveis sinais de malignidade) nas lesões melanocíticas e que podem orientar o patologista a realizar estudo e/ou recortes adicionais para correlação clínica
- Rede pigmentar irregular. Rede heterogênea de linhas formadas por cristas epidérmicas variando em distância, espessura e coloração, como resultado de proliferação melanocítica intraepidérmica e juncional desordenada.
- Glóbulos de tamanhos variados e irregularmente distribuídos. Indica a presença de ninhos melanocíticos intradérmicos com dimensões diferentes, formato heterogêneo, e que se dispõem de maneira desordenada.
- Estrias radiadas. Extensões radiais de uma rede pigmentar correspondentes a melanoma em fase de crescimento radial.
- Pseudópodes. Projeções periféricas bulbosas de uma rede pigmentar indicando melanoma em fase de crescimento radial.
- Véu azul-acinzentado. Padrão homogêneo formada por área parcial de coloração azulada com branco fosco sobreposto. Achado específico para melanoma, geralmente invasivo.
- Cristas paralelas (nas lesões melanocíticas acrais). Indica proliferação melanocítica nas cristas profundas intermédias da epiderme, que se projeta em colunas pigmentadas para as cristas dermatoglíficas. De regra, as linhas pigmentadas são desprovidas dos pontos brancos correspondentes às aberturas dos ductos écrinos destruídos pelo melanoma (Fig. 2).
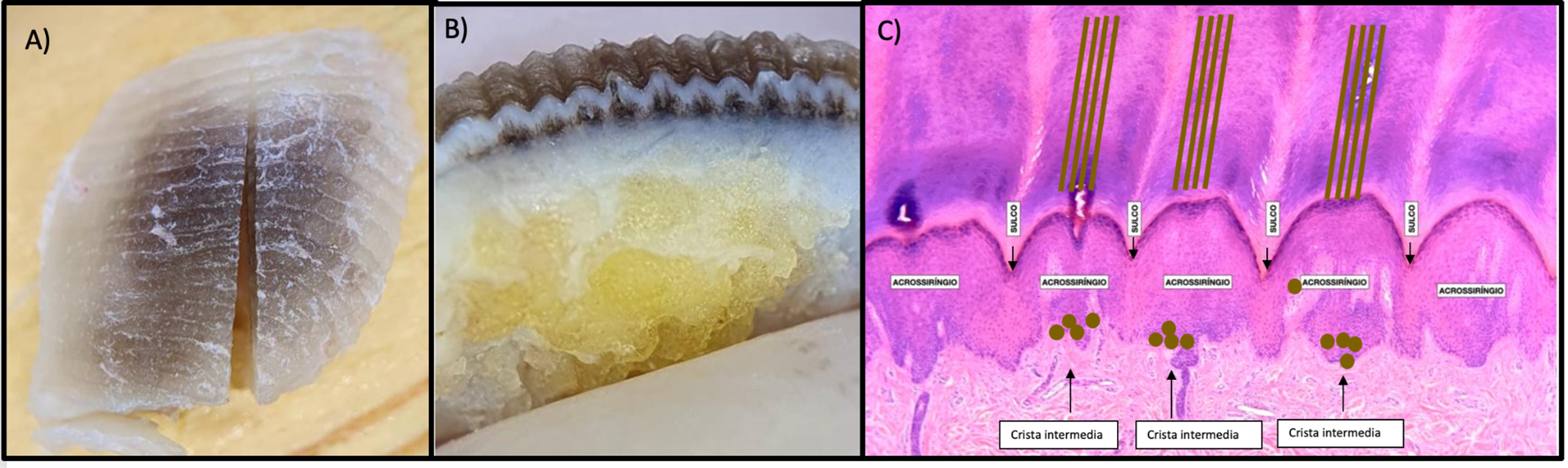
Fig. 2. Características macroscópicas e microscópicas de lesões melanocíticas suspeitas da área acral. (A) Aspecto macroscópico de lesão melanocítica na região acral. (B) Corte macroscópico perpendicular às linhas da superfície da pele acral evidenciando pigmentação difusa das cristas e sulcos da epiderme. (C) Característica histológica (H&E) da pele em região acral, com esquema representativo de proliferação melanocítica maligna nas cristas intermedians e correspondente aspecto clínico suspeito de malignidade de cristas pigmentadas.
2. Realizando a biópsia
2.1 Escolha da técnica de biópsia
- Biópsia excisional com margens livres. Deve ser a abordagem preferencial.
- Biópsia incisional. Deve ser evitada nas lesões suspeitas para melanoma, porém pode ser adequada nas lesões com grandes dimensões ou nas lesões situadas em regiões de preocupação estética ou funcional.
- Biópsia por shave. É desencorajada porque pode dificultar o diagnóstico e, no futuro, comprometer a correta determinação da espessura de Breslow.
2.2 Fixação
A amostra obtida para o exame histopatológico deve ser, imediatamente após a sua retirada, submersa em recipiente transparente e de boca larga, contendo formalina tamponada (formol tamponado a 10%) em volume cerca de 20x o tamanho da amostra. O tempo ideal de fixação varia entre 6 a 72 horas.
2.3 Requisição de exame histopatológico
Além dos dados pessoais e epidemiológicos do paciente, é importante que a requisição contenha a descrição sumária do quadro clínico, sua evolução, resultados de exames complementares e hipóteses diagnósticas, pois fazem parte dos pré-requisitos para um laudo completo e contextualizado.
- A faixa etária interfere na interpretação dos achados microscópicos. Lesões melanocíticas de surgimento recente em pessoas maiores de 40 anos devem ser encaradas como suspeitas para melanoma. Por outro lado, os mesmos achados microscópicos que conduziriam ao diagnóstico de melanoma em um paciente idoso, em um paciente pediátrico podem não significar evidência de malignidade.
- Localização. Lesões melanocíticas situadas nos chamados “sítios especiais” (p.ex.: couro cabeludo, genitália, linha mamária, pavilhão auricular e regiões flexurais) podem ser benignas, mesmo que revelem achados microscópicos alarmantes.
- Descrição clínica da lesão. Regra do ABCDE (assimetria, bordas, coloração, diâmetro e evolução), bem como qualquer outra informação relevante (p.ex.: aumento de tamanho, mudanças de características, ocorrência de trauma, resultado de biópsias prévias, surgimento de ulceração, etc.).
- História clínica. História pregressa pessoal e história familiar de melanoma e de nevos displásicos.
- Outros exames. Descrição da dermatoscopia e, caso se aplique, de outros exames complementares (p.ex.: microscopia confocal).
3. Avaliação laboratorial pré-analítica
3.1 Macroscopia
- Descrição. A descrição da peça cirúrgica permite correlacionar as características macroscópicas com os achados microscópicos da lesão (Fig. 3). Devem ser descritas a medida da peça cirúrgica e as características macroscópicas da lesão, tais como coloração, relevo, circunscrição, tamanho e distância em relação às margens. Em caso de mais de uma lesão, estas devem ser descritas separadamente e as distâncias entre elas devem ser medidas. A manipulação excessiva deve ser evitada para prevenir artefatos de esmagamento.
- Recomenda-se seccionar a peça cirúrgica somente após sua completa fixação, de modo a permitir cortes macroscópicos mais precisos. De preferência, o seccionamento deve ser realizado por meio de cortes perpendiculares à superfície da peça, com espessuras uniformes, idealmente 2-3mm, e seriados no sentido do maior eixo (Fig. 4). Nos casos de lesão melanocítica em região acral, é necessário fazer cortes transversais em relação às linhas dermatoglíficas para permitir a visualização do padrão microscópico correspondente e a averiguação de critérios diagnósticos importantes (Fig. 5).
- O material, sempre que possível, deve ser submetido em sua totalidade, idealmente com poucas secções em cada cassete para permitir a precisa inclusão do material, sem sobreposição dos fragmentos no bloco/lâmina final. A face do corte macroscópico deve ser posicionada para baixo nos cassetes, obedecendo a sequência das secções realizadas, e os cassetes devem ser identificados quanto a essa sequência. Nos casos com mais de uma lesão, mapear todas elas de maneira a identificar cada uma individualmente e a região representativa de pele normal entre as lesões.
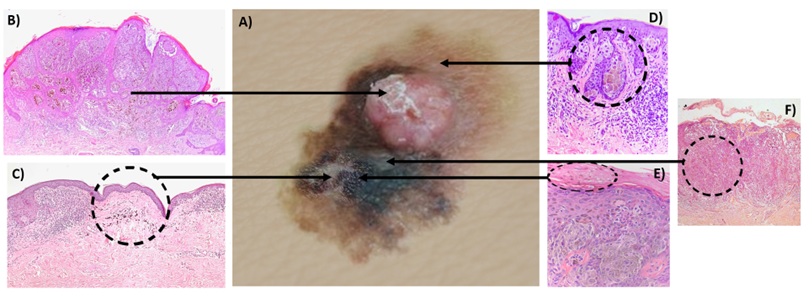
Fig. 3. Figura esquemática correlacionando aspecto macroscópico (A) com correspondência microscópica (B-F) de uma lesão melanocítica. (A) Aspecto macroscópico evidenciando área plana e área elevada. Na área plana notam-se diferentes tons de coloração. (B) Área elevada caracterizando melanoma com padrão de crescimento vertical tumorigênico. (C) Coloração esbranquiçada indica área de regressão/fibrose na microscopia. (D) Áreas marrons em região de interface entre a derme e a epiderme. (E) Coloração enegrecida indica pigmentação mais superficial. (F) Cor acinzentada indicando lesão mais profunda na derme.

Fig. 4. Espécime excisional de lesão melanocítica de pele com esquema representativo de macroscopia recomendada para a representação histológica do melanoma. Recomenda-se realizar cortes seriados perpendiculares à superfície, no sentido do maior eixo do espécime, e representar a lesão em sua totalidade para avaliação microscópica.
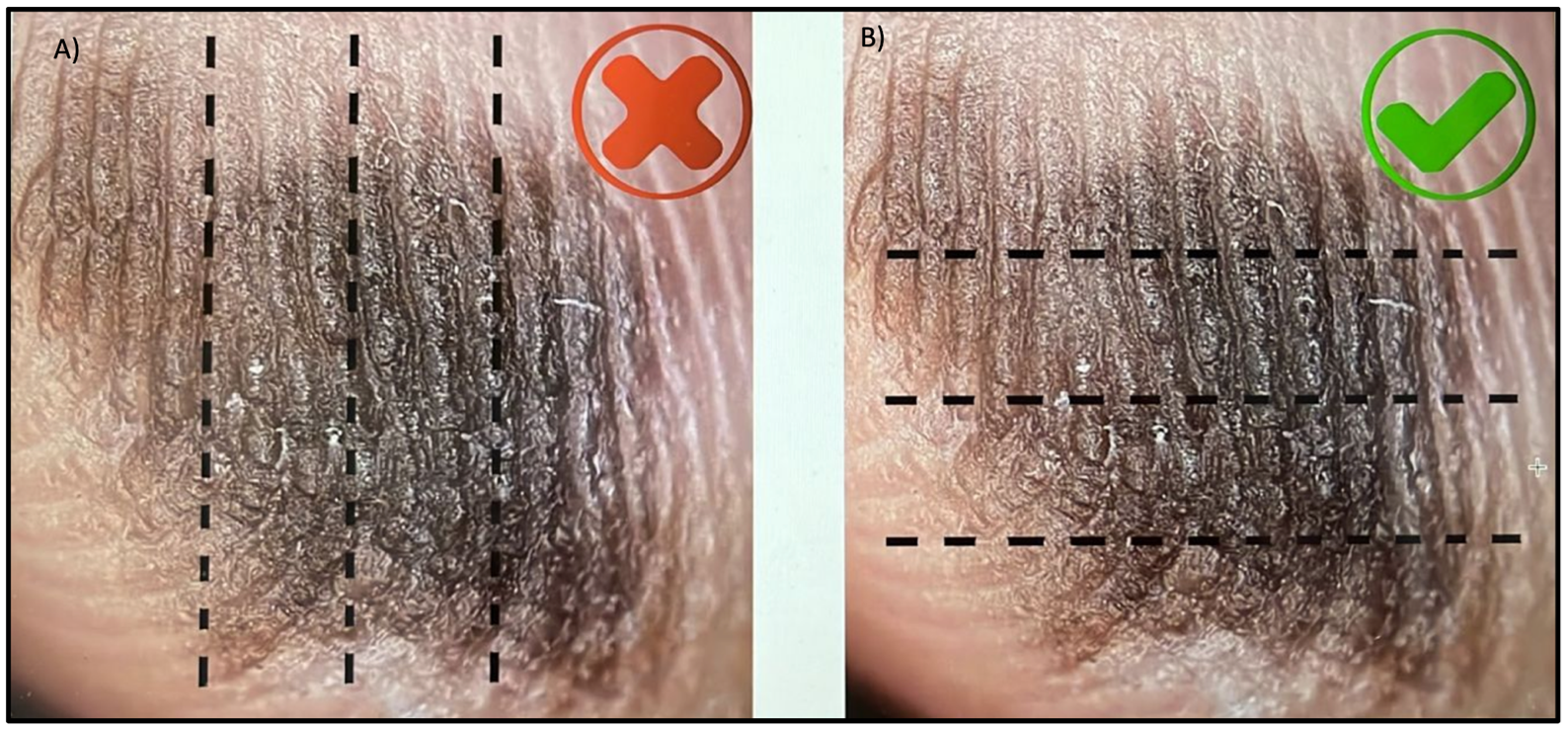
Fig. 5. Direcionamento de secções que devem ser realizadas na macroscopia para avaliação microscópica de lesões melanocíticas acrais. (A) Não é indicado realizar cortes no sentido paralelo/longitudinal dos sulcos. (B) Sentido recomendado para os cortes macroscópicos seguindo perpendicularmente os sulcos.
3.2 Inclusão
A inclusão deve permitir distribuição na lâmina sem sobreposição dos fragmentos e garantindo completa visualização da epiderme e das tintas nas margens cirúrgicas. Quando consta de mais de um fragmento por cassete, considerar o alinhamento da posição da epiderme em linha reta.
Em caso de lesões muito pequenas, não identificadas com os cortes seriados, pode ser necessária a reinclusão com inversão da face de corte do bloco de parafina.
3.3 Microtomia
Cortes seriados adicionais são recomendados em muitos casos, incluindo lesões atípicas, lesões com dificuldade diagnóstica, discordância morfológica inicial com exames complementares (dermatoscopia e microscopia confocal), a depender do caso, podendo ser aplicado a todos os blocos da lesão.
4. Exame microscópico
- Principais critérios microscópicos aplicados às lesões melanocíticas
4.1.1 Critérios arquiteturais
- Circunscrição. Lesões bem circunscritas tendem a ser benignas, com o alerta de que essa mesma característica é também encontrada no melanoma nodular e no melanoma metastático epidermotrópico.
- Semelhança entre as duas metades verticais da lesão e entre as células situadas no mesmo nível horizontal é indicativa de benignidade.
- Intensidade de proliferação.
- Tamanho e disposição dos ninhos. Nas lesões melanocíticas benignas, os ninhos se distribuem de maneira regular e possuem dimensões e formatos semelhantes.
- Padrão reacional da epiderme. Hiperplasia epidérmica uniforme, mais evidente na parte central, ocorre comumente em lesões melanocíticas benignas, enquanto hiperplasia irregular e consumo da epiderme indicam melanoma.
4.1.2 Critérios citológicos
- Atipia citológica (tamanho, forma, cromasia). Pleomorfismo, hipercromasia nuclear e presença de macronucléolos favorecem melanoma, embora o melanoma nevoide seja constituído de células pequenas e mais monomórficas.
- Disseminação pagetoide. Ascensão difusa e extensa de células atípicas pela epiderme e tropismo pelo epitélio anexial são típicos do melanoma, não obstante lesões melanocíticas benignas possam apresentar disseminação intraepidérmica regular de células monomórficas com menor intensidade ou restrita à parte central quando localizadas nas regiões acrais de indivíduos jovens, quando submetidas a trauma ou quando irritadas.
- Fibroplasia dérmica. Ainda que a fibroplasia dérmica concêntrica e lamelar seja um critério clássico para o diagnóstico de nevo displásico, a presença de fibroplasia não exclui a possibilidade de lesão maligna.
- Grau de elastose solar. Lesões melanocíticas situadas em área com fotodano, sobretudo em indivíduos idosos, devem ser encaradas quase que certamente como melanoma, ainda que os demais achados possam sugerir benignidade.
- Infiltrado inflamatório. Melanoma tende a apresentar infiltrado linfocítico distribuído de forma irregular pela lesão, característica que também pode ser encontrada no nevo combinado benigno quando o componente inflamatório se restringe a apenas uma das populações névicas. A presença de plasmócitos deve despertar a suspeita de lesão maligna.
- Maturação. Diminuição do tamanho dos ninhos e dos melanócitos em direção à parte profunda favorece lesão melanocítica benigna, apesar de que esse achado pode ser também encontrado em lesões malignas como o melanoma nevoide e o melanoma metastático, e de que lesões benignas como o nevo azul sejam desprovidas desse achado.
- Figuras mitóticas típicas, escassas, não agrupadas e restritas à parte superficial ocorrem com frequência em lesões melanocíticas benignas. Figuras mitóticas em quantidade aumentada e presentes também na parte profunda podem ser encontradas em lesões melanocíticas benignas de crianças, adolescentes e mulheres grávidas, porém devem despertar suspeita de melanoma, principalmente se associadas a mitoses atípicas e agrupadas.
- Regressão. Achado mais frequentemente encontrado nas lesões malignas cujo significado biológico ainda permanece em discussão.
- Lesões benignas tendem a ser simétricas enquanto lesões malignas tendem a ser assimétricas; ou seja, se realizarmos um corte imaginário na metade da lesão, os dois lados apresentam características microscópicas distintas.
- Ulceração. Quando há consumo da epiderme que circunda a ulceração e não existem sinais de trauma, a presença de ulceração é típica de melanoma e indica prognóstico ruim.
- Predomínio de células isoladas/ninho.
- Pigmentação. Alternância de áreas intensamente pigmentadas com áreas desprovidas de pigmento é indicativa de melanoma, embora o nevo combinado também possa apresentar distribuição irregular do pigmento. Pigmento escasso, homogeneamente distribuído e concentrado na parte superficial é típico da maioria das lesões melanocíticas benignas, mas também é observado no melanoma amelanótico.
Para os critérios de elaboração de laudo microscópico estruturado, consultar o Manual de Padronização de Laudos Histopatológicos da Sociedade Brasileira de Patologia:
https://www.sbp.org.br/manual-de-laudos-histopatologicos/pele-melanoma-cutaneo/
5. Exame imuno-histoquímico
-
- Aplicações em lesões primárias da pele
O papel do exame imuno-histoquímico pode ser de ferramenta confirmatória em relação à natureza melanocítica da neoplasia ou contribuir na diferenciação entre lesões benignas ou malignas.
5.1.1 Casos de difícil interpretação
- Marcadores melanocíticos bastante sensíveis (p.ex.: MITF, SOX10 e S100) e específicos (p.ex.: MART1) são usados para detectar a densidade celular e o padrão de crescimento neoplásico quando não é possível na coloração de rotina (devido à coexistência de inflamação, artefato, etc). Contudo, não determinam se a lesão é maligna ou benigna.
- MART-1 (Melanoma Antigen Recognized by T cells-1) – também conhecido como Melan-A
- MiTF (Microphthalmia Transcription Factor)
- SOX-10 (SRY-related HMG-bOX-10) sensível nos melanomas desmoplásicos
- S100 sensível nos melanomas desmoplásicos
- Marcadores com valor para o diagnóstico diferencial entre nevo e melanoma
- HMB-45 (Human Melanoma Black-45). Nas lesões benignas, evidencia a maturação, pois há uma coloração em gradiente, mais forte nas porções superiores. Pode ser positivo no nevo azul, nevo profundo penetrante e nevo de Spitz. Útil na diferenciação entre nevo e metástases subcorticais na avaliação do linfonodo sentinela.
- Ki-67. Avaliação da proliferação celular. Não é específico para melanócitos, por isso a marcação dupla MART1/ki67 é bastante efetiva nos casos de dúvida interpretativa. Nevos geralmente apresentam baixo índice de proliferação celular. Dupla marcação com MART-1 utilizando corante magenta e Ki-67 pode ser útil em casos com proeminente infiltrado inflamatório.
- PRAME (PReferentially expressed Antigen in MElanoma). Marcador recente e mais eficiente para distinguir entre nevos e melanomas, com marcação preferencial no melanoma em relação às lesões benignas. Não é um bom marcador para melanoma desmoplásico.
- Proteína p16. Como parte de regulação de supressão do ciclo celular, a perda de marcação indica acquisição de vantagem proliferativa. Deve ser usada com cautela e sob correlação clínico-patológica no diagnóstico diferencial entre nevo e melanoma.
5.1.2 Técnicas especiais para casos muito pigmentados
- Contracoloração com magenta ou Giemsa
- Despigmentação com peróxido de hidrogênio
6. Alterações moleculares
Os melanomas são divididos em nove subgrupos, e cada grupo possui características clínicas, morfológicas e ainda alterações moleculares que podem auxiliar na correta classificação da lesão e potencialmente para uso terapêutico. Para fins de seleção de tratamento do paciente com melanoma, são descritos os seguintes possíveis marcadores:
- Mutações no gene BRAF para tratamento com inibidores de BRAF. Presente em aproximadamente 50% dos melanomas, as principais mutações do gene BRAF envolvem o códon 600, sendo a mutação V600E a mais frequente. Mutação de BRAF não define malignidade, pois nevos também apresentam frequentemente mutação nesse gene. É necessária fixação adequada da amostra com formol tamponado e representação suficiente de células tumorais para realização do teste.
- Mutações no gene NRAS para tratamento com inibidores de MEK
- Mutações no gene KIT para tratamento com inibidores de KIT
- Fusões em ALK, NTRK1/2/3, ROS1, BRAF e respectivos inibidores da tirosina-cinase
7. Outros exames relacionados ao melanoma
7.1 Exame per-operatório
Está desaconselhado qualquer tipo de exame de congelação, incluindo cirurgia micrográfica de Mohs, para definição de margens ou diagnóstico de lesão melanocítica primária da pele, ou linfonodo sentinela. O padrão-ouro para avaliação de margens cirúrgicas é o exame microscópico de lâminas coradas por hematoxilina-eosina após o processamento histológico da amostra.
Não há tecnologia validada de uso acessível sobre realização de estudo imuno-histoquímico per-operatório até o momento atual.
7.2 Ampliação de margens cirúrgicas (apenas cicatriz, sem lesão melanocítica residual)
- Informações clínicas. Obter informação sobre o exame anterior, incluindo detalhes sobre o diagnóstico (p.ex.: tipo do melanoma, lesão in situ X invasiva, medida da espessura de Breslow, etc.) e o status das margens.
- Realizar cortes seriados macroscópicos perpendiculares à superfície da peça cirúrgica, de espessuras uniformes, idealmente 2-3 mm, e seriados no sentido do maior eixo do espécime, atentando-se para a cuidadosa inspeção macroscópica na busca de anormalidades (Fig. 6).
- Recomenda-se, sempre que possível, a inclusão de toda a peça cirúrgica. Diante da impossibilidade de inclusão de todo o material, é necessário que a análise macroscópica seja minuciosa em busca de áreas suspeitas para satelitose ou neoplasia residual que, se identificadas, devem ser amostradas para exame microscópico para avaliação do status da margem cirúrgica. Recomenda-se ainda que a área cicatricial seja bem representada, especialmente a região mais próxima da margem cirúrgica.
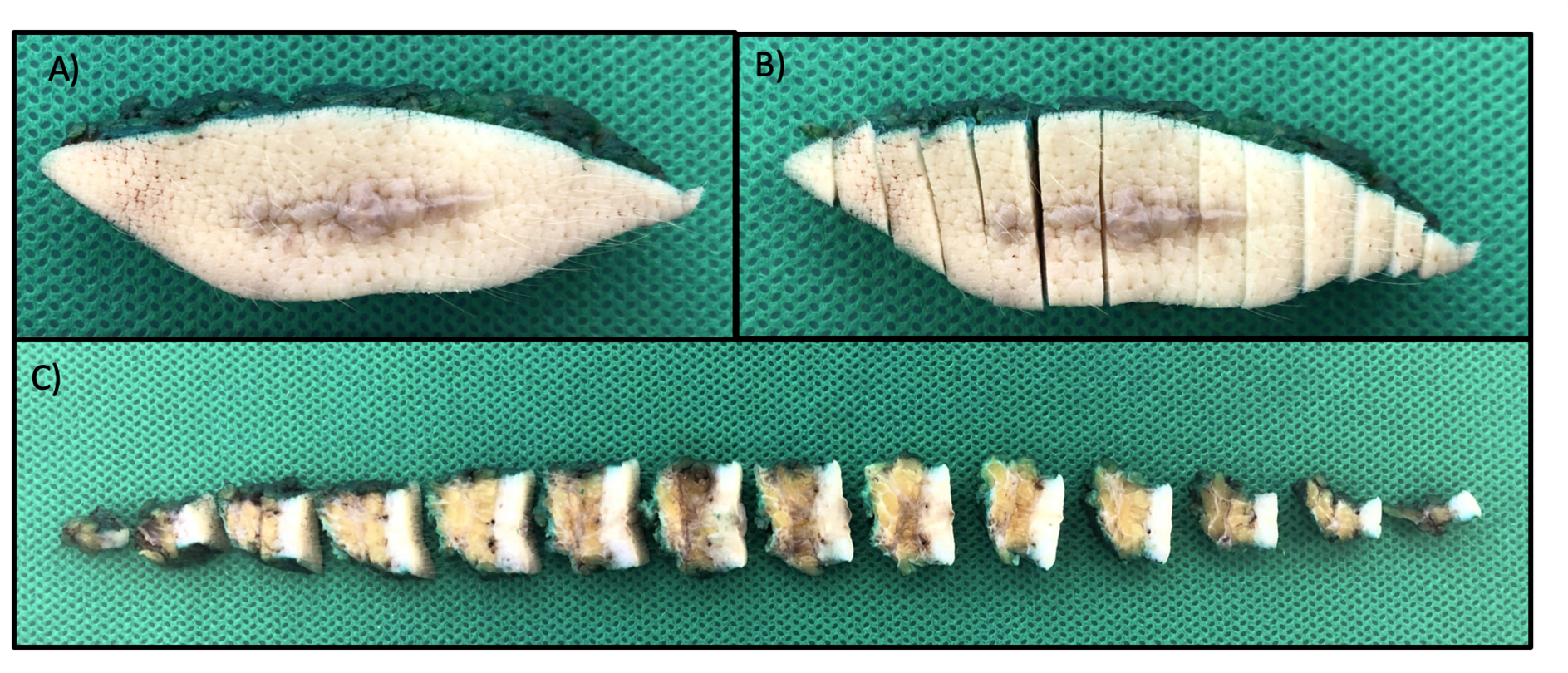
Fig. 6. Macroscopia e representação histológica de espécimes de ampliação de margem de melanoma. (A) Aspecto macroscópico de pele de ampliação de margens de excisão prévia de melanoma evidenciando cicatriz central. (B-C) Recomenda-se realizar cortes seriados perpendiculares à superfície, no sentido do maior eixo do espécime, e representar a cicatriz em sua totalidade para avaliação microscópica.
7.3 Linfonodo sentinela de melanoma
Manuseio cuidadoso é recomendado para não danificar a cápsula linfonodal. Os cortes devem ser preferencialmente realizados de maneira seriada e perpendicular ao maior eixo da peça cirúrgica (Fig. 7), seguidos de amostragem total. No caso de encaminhamento de mais de um linfonodo, devem ser mantidas em separado as suas identificações e descrições.
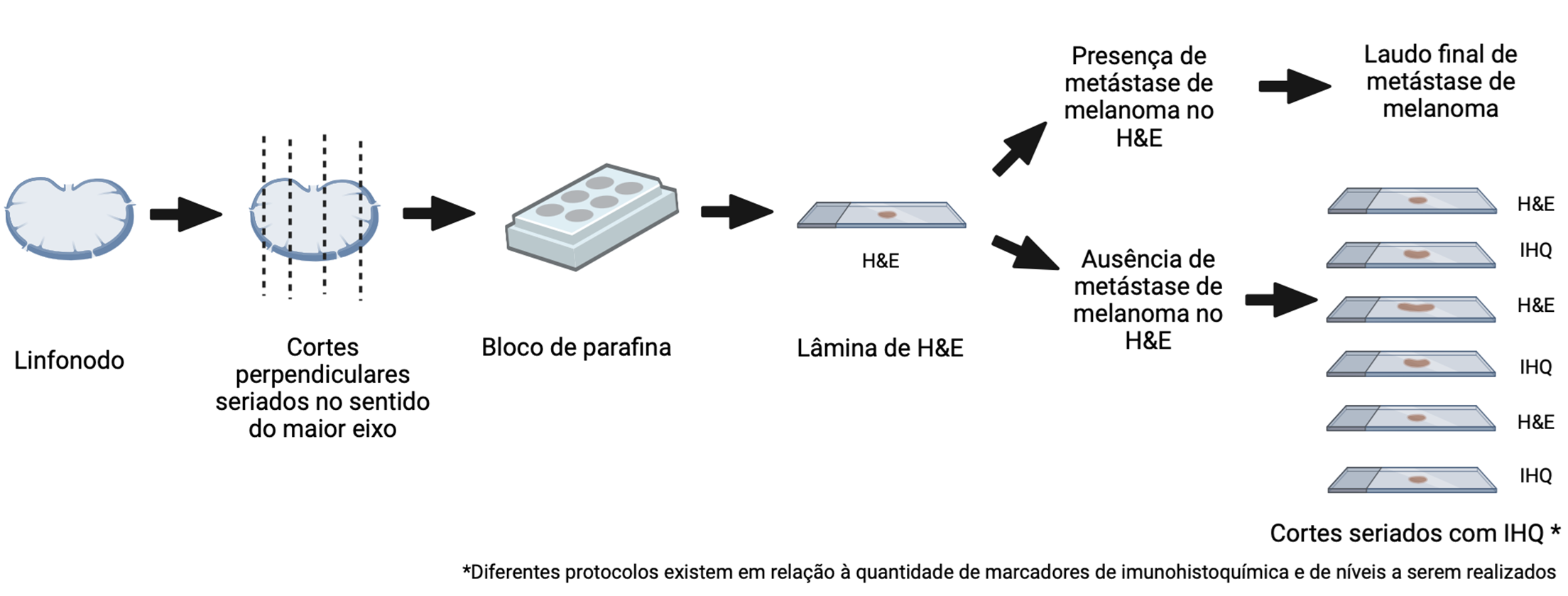
Fig. 7. Esquema representativo de cortes seriados que devem ser realizados no linfonodo sentinela para avaliação microscópica na sua totalidade. Casos negativos na avaliação de rotina pela coloração de hematoxilina e eosina devem ser avaliados pelo método de imuno-histoquímica.
REFERÊNCIAS
- Ankad BS, Mukherjee SS, Nikam BP (eds). Dermoscopy-Histopathology Correlation: a conspectus in the skin of colour. Singapore: Springer; 2021.
- Barnhill RL, Elder DE, Piepkorn MW, et al. Revision of the Melanocytic Pathology Assessment Tool and Hierarchy for Diagnosis Classification Schema for Melanocytic Lesions: a consensus statement. JAMA Netw Open. 2023;6(1):e2250613.
- Garbe C, Amaral T, Peris K, et al. European consensus-based interdisciplinary guideline for melanoma. Part 1: Diagnostics – Update 2019. Eur J Cancer. 2020;126:141‒158.
- Hosler GA, Murphy KM. Ancillary testing for melanoma: current trends and practical considerations. Hum Pathol. 2023:140:5‒21.
- Massi G, LeBoit PE. Histological Diagnosis of Nevi and Melanoma. 2nd ed. Heidelberg: Springer; 2021.
- Michielin O, van Akkooi ACJ, Ascierto PA, et. al. Cutaneous melanoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2019;30(12):1884‒1901.
- Swetter SM, Tsao H, Bichakjian CK, et al. Guidelines of care for the management of primary cutaneous melanoma. J Am Acad Dermatol. 2019;80(1):208‒250.
Autores
José Cândido Caldeira Xavier Junior4,5, Karina Munhoz de Paula Alves Coelho1, Mariana Petaccia de Macedo3, Robledo Fonseca Rocha2,6, Rute Facchini Lellis3,7
1 CEDAP, Centro de Diagnósticos Anátomo-Patológicos, Joinville (SC), Brasil
2 Centro de Ciências da Saúde, Universidade Federal de Roraima, Boa Vista (RR), Brasil
3 Departamento de Patologia, Rede D’Or/São Luiz Hospital, São Paulo (SP), Brasil
4 Faculdade de Medicina, Centro Universitário Católico Unisalesiano, Araçatuba (SP), Brasil
5 Instituto de Patologia de Araçatuba (SP), Brasil
6 Laboratório de Patologia de Roraima, Boa Vista (RR), Brasil
7 Santa Casa de Misericórdia de São Paulo (SP), Brasil
