Autores
Raimundo Gerônimo da Silva Júnior, Laura Carolina López Claro, Aloísio Souza Felipe da Silva, Cleto Dantas Nogueira, Emilio Augusto Campos Pereira de Assis, Evandro Sobroza de Mello, Igor Campos da Silva.
1. Definição
Os tumores do estroma gastrointestinal (GIST) são neoplasias mesenquimais de comportamento variável, que se originam de células intersticiais de Cajal ou de precursores dessas células. Essas células são responsáveis pela regulação da motilidade gastrointestinal.
2. Localização
Os GISTs podem surgir em qualquer segmento do trato gastrointestinal, com a seguinte distribuição:
- Estômago: 54% dos casos, sendo a localização mais frequente.
- Intestino delgado (incluindo o duodeno): 30%.
- Cólon e reto: 5%.
- Esôfago: cerca de 1%.
Casos no apêndice são extremamente raros.
Cerca de 10% dos GISTs já se apresentam disseminados no momento do diagnóstico, dificultando a identificação do sítio primário. Tumores extra gastrointestinais, localizados predominantemente no mesentério, omento e retroperitônio, geralmente representam metástases de uma massa primária não reconhecida ou tumores que perderam a conexão com o trato gastrointestinal.
3. Apresentação Clínica
Os GISTs podem se manifestar de forma variada, dependendo de seu tamanho, localização e estágio. As principais apresentações incluem:
- Sintomas inespecíficos: dor abdominal vaga e desconforto.
- Complicações relacionadas à mucosa: ulceração, sangramento (agudo ou crônico) e, ocasionalmente, perfuração.
- Massas abdominais: palpáveis no exame físico ou identificadas em estudos de imagem.
Tumores em estágio avançado frequentemente apresentam disseminação intraperitoneal ou retroperitoneal, com o fígado sendo o principal local de metástases.
Diferenças Comportamentais por Localização
- GISTs gástricos: geralmente apresentam comportamento menos agressivo, embora tenham maior taxa de recorrência local.
- GISTs do intestino delgado: tendem a ser mais agressivos, com maior frequência de disseminação peritoneal e metástases distantes.
4. Etiologia:
A maioria dos tumores do estroma gastrointestinal (GIST) é esporádica, mas entre 5% e 10% dos casos está associada a síndromes genéticas específicas.
GISTs Esporádicos
A maioria dos GISTs ocorre de forma isolada, sem associação com condições hereditárias. Esses casos são geralmente relacionados a mutações somáticas nos genes KIT ou PDGFRA, que levam à ativação constitutiva de receptores tirosina-quinase.
GISTs Sindrômicos
Os GISTs associados a síndromes hereditárias são frequentemente caracterizados por deficiência da enzima succinato desidrogenase (SDH), que desempenha papel crucial no metabolismo celular. As principais síndromes relacionadas incluem:
- Tríade de Carney: Caracterizada pela presença de GIST, paraganglioma e cordoma pulmonar.
- Síndrome de Stratakis-Carney: Combinação de GIST e paraganglioma.
GISTs na Neurofibromatose Tipo 1 (NF1): Em pacientes com NF1, o desenvolvimento de GISTs é raro, mas, quando ocorre, os tumores geralmente multifocais, localizados no intestino delgado e apresentam comportamento biológico geralmente menos agressivo.
GISTs Familiares: Casos familiares de GIST são extremamente raros e causados por mutações germinativas nos genes KIT ou PDGFRA. Esses tumores frequentemente são multifocais e de comportamento mais agressivo.
5. Achados microscópicos:
A maioria dos GISTs é constituído por células fusiformes, com morfologia epitelioide vista em 20 a 25% dos casos e alguns com morfologia mista.
GIST de células fusiformes: As células mostram um arranjo difusamente ou vagamente estoriforme, com citoplasma eosinofilico, por vezes exibindo vacúolos e raramente núcleos pleomórficos.
- Padrões histológicos distintos incluem o esclerosante, paliçada-vacuolado, hipercelular difuso e sarcomatoso com atipias nucleares e mitoses.
- Os GISTs do intestino delgado e cólon têm geralmente essa morfologia e aqueles que mostram glóbulos colagênicos extracelulares (fibras skenoides) mostram baixo potencial biológico.
GIST de células epitelioides: As células podem exibir citoplasma claro a eosinofílico e podem mostrar morfologia esclerosante, descoesa, hipercelular ou sarcomatosa, com atipias e mitoses proeminentes.
- GISTs SDH-deficientes mostram esta morfologia,tem localização gástrica, multinodularidade e aumento de invasão angiolinfática e metástase ganglionar.
GIST desdiferenciado: Trata-se de progressão para morfologia sarcomatosa de alto grau (KIT-negativa) que pode ocorrer de novo ou após tratamento com imatinib.
- Nestes casos podemos observar diferenciação heteróloga epitelial, miogênica ou angiossarcomatosa.
5.1 Achados Imuno-histoquímicos
- KIT (CD117): A maioria dos GISTs apresenta expressão forte e difusa de KIT, com padrão de coloração citoplasmática, associado à membrana ou, ocasionalmente, perinuclear.
No entanto, cerca de 5% dos GISTs, especialmente os associados a mutações em PDGFRA, podem ser KIT-negativos ou apresentar coloração limitada.
- DOG1 (ANO1): Um marcador altamente sensível e específico, expressado independentemente do status de KIT.
É particularmente útil para identificar GISTs KIT-negativos, com positividade em até 50% dos casos não detectados por CD117.
- CD34: Expressão frequente, especialmente em GISTs de células fusiformes, predominantemente gástricos e menos consistentemente positivo em tumores de morfologia epitelioide.
- Actina de músculo liso: Presente em uma minoria dos GISTs, geralmente com intensidade variável.
- H-caldesmon: Positivo em alguns casos, indicando diferenciação mioide.
- Desmina: Expressão rara e focal, não sendo um marcador confiável para GISTs.
- Queratinas (CK18) e S100: Positividade observada em raros casos e geralmente focais.
- SDHB: A perda de expressão de SDHB caracteriza GISTs deficientes em SDH, independentemente de qual gene da cadeia SDH está mutado.
- SDHA: Perda de SDHA é específica para GISTs com mutações no gene SDHA.
- Neurofibromina (NF1): A ausência de neurofibromina (avaliada por um anticorpo específico para o C-terminal) pode indicar associação com neurofibromatose tipo 1 (NF1).
6. Patologia Molecular: Implicações Práticas
KIT (75% dos casos):
- Exon 11: Mais comum, associada a boa resposta ao imatinibe.
- Exon 9: Comum em GISTs do intestino delgado, requer doses mais altas de imatinibe.
- Exons 13 e 17: Menos frequentes, geralmente sensíveis ao imatinibe, mas podem exigir inibidores de segunda geração.
PDGFRA (10% dos casos):
- Exon 18 (p.Asp842Val): Predominante em GISTs gástricos e geralmente resistente ao imatinibe.
- Outras mutações: Geralmente com comportamento menos agressivo e sensíveis a terapias-alvo.
GISTs KIT/PDGFRA Selvagens (5-10%)
Deficiência de SDH:
- Comum em jovens e associado à tríade de Carney.
- Perda de SDHB detectada por imuno-histoquímica é diagnóstica.
- Não respondem ao imatinibe; manejo é baseado em ressecção cirúrgica e vigilância.
Mutação NF1: Associada à neurofibromatose tipo 1, frequentemente múltiplos, sem resposta ao imatinibe.
Alterações Raras
- BRAF e KRAS: Mutações ativadoras, ocasionalmente encontradas, podem responder a inibidores de MEK.
- Fusões genéticas (NTRK, FGFR1): Extremamente raras, indicam elegibilidade para terapias específicas como inibidores de TRK.
Progressão Molecular
- Mutações adicionais em genes como TP53 ou RB1 indicam tumores mais agressivos.
- GIST desdiferenciado pode apresentar resistência a terapias-alvo.
7. Fatores Prognósticos
O prognóstico dos GISTs é definido por uma combinação de fatores clínicos, histológicos e moleculares, que influenciam o risco de recorrência e metástase:
Localização Tumoral:
- GISTs gástricos tendem a ser menos agressivos.
- Tumores do intestino delgado, reto e cólon apresentam maior risco de metástases.
Tamanho do Tumor
- Tumores maiores que 5 cm têm risco significativamente aumentado de recorrência.
Índice Mitótico
- Um índice superior a 5 mitoses por 5mm2 está associado a pior prognóstico.
Ruptura Tumoral
- A ruptura intraoperatória ou espontânea é um forte preditor de disseminação peritoneal e recorrência.
Perfil Molecular
- Mutação no KIT exon 11: Risco intermediário de recorrência.
- Mutação no PDGFRA exon 18 (p.Asp842Val): Resistente ao imatinibe e associado a comportamento mais agressivo.
- Deficiência de SDH: Geralmente em pacientes jovens, com maior propensão a metástases linfonodais.
Margens Cirúrgicas
- Ressecções com margens positivas aumentam o risco de recorrência local.
| Parâmetros | Risco de progressão da doença (%) | ||||
| Índice mitótico | Tamanho | Estômago | Duodeno | Íleo/Jejuno | Reto |
| ≤5 per 5 mm2 | ≤2 cm | Nenhum (0%) | Nenhum (0%) | Nenhum (0%) | Nenhum (0%) |
| >2 – ≤5 cm | Muito baixo (1.9%) | Baixo (8.3%) | Baixo (4.3%) | Baixo (8.5%) | |
| >5 – ≤10 cm | Baixo (3.6%) | Dados insuficientes | Moderado (24%) | Dados insuficientes | |
| >10 cm | Moderado (10%) | Alto (34%) | Alto (52%) | Alto (57%) | |
| >5 per 5 mm2 | ≤2 cm | Nenhum
(Pequeno número de casos) |
Dados insuficientes | Alto
(Pequeno número de casos) |
Alto (54%) |
| >2 – ≤5 cm | Moderado (16%) | Alto (50%) | Alto (73%) | Alto (52%) | |
| >5 – ≤10 cm | Alto (55%) | Dados insuficientes | Alto (85%) | Dados insuficientes | |
| >10 cm | Alto (86%) | Alto (86%) | Alto (90%) | Alto (71%) | |
8. Relatório histopatológico de peças cirúrgicas com Tumor estromal gastrointestinal (GIST) – Recomendações
- Procedimento realizado
- Sítio do tumor
- Tamanho (maior dimensão em cm)
- Focalidade
- Tipo histológico (fusocelular, epitelioide ou misto)
- Índice mitótico por 5mm2
A contagem total de mitoses deve ser realizada em uma área de 5 mm² na lâmina histológica. Em microscópios antigos, 50 campos de grande aumento correspondem a 5 mm². Já em microscópios modernos, com lentes 40x mais amplas, são necessários aproximadamente 20 a 25 HPF para cobrir essa área. Caso necessário, é recomendável medir o campo de visão do microscópio para determinar com precisão o número de campos necessários para atingir os 5 mm².
- Necrose (ausente ou presente em %)
- Grau histológico
- G1: Baixo grau; taxa mitótica ≤5/5 mm2
- G2: Alto grau; taxa mitótica >5/5 mm2
- GX: O grau não pode ser avaliado
- Avaliação de Risco (Ver quadro acima)
- Nenhum
- Risco muito baixo
- Baixo risco
- Risco moderado
- Alto risco
- Claramente maligno/metastático
- Não pode ser determinado
- Margens
- Não pode ser avaliada.
- Livre com distância em cm para o tumor (especificar qual margem se possível)
- Comprometida (especificar qual margem se possível)
- Linfonodos (citar o número de linfonodos examinados e comprometidos)
- Estadiamento patológico (pTNM, AJCC 8ª edição)
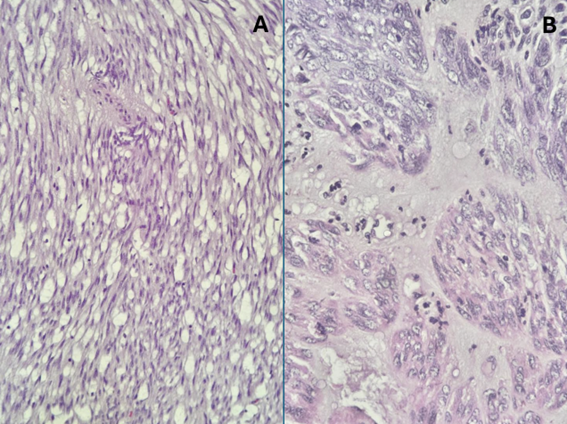
A. GIST de células fusiformes; B. GIST de células epitelióides.
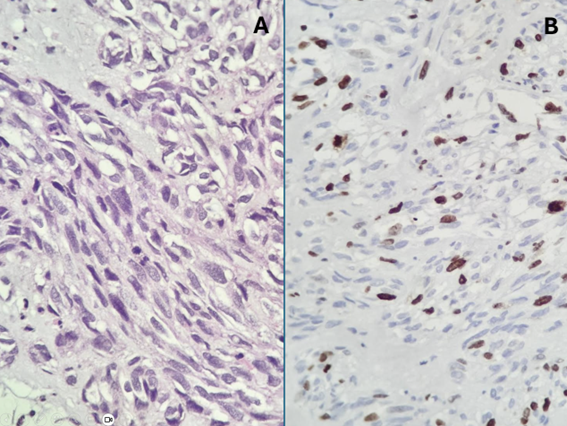
A. GIST com padrão morfológico misto, fusiforme e epitelióide e com figuras de mitose;
B. índice de Ki-67 é bastante alto neste caso.
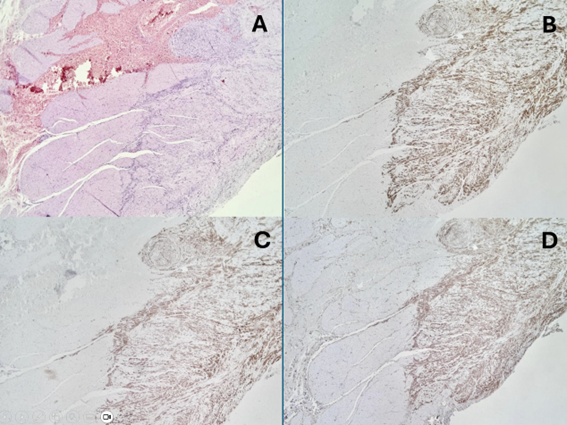
A. Um pequeno GIST ocupando parte da espessura da parede muscular do estômago (parte de baixo e á direita do campo;
B. Positividade imuno-histoquímica intensa e difusa para c-kit;
C. Positividade forte para DOG-1;
D. Positividade para CD34. Estes 3 marcadores, juntamente com a negatividade para desmina, são os mais comumente usados para confirmação do diagnóstico.
