Carmen Lucia Penteado Lancelotti, Francine Hehn de Oliveira, Felipe D’Almeida Costa, Jean Costa Nunes, Aline Helen da Silva Camacho
Parte I Epilepsias
Código nosológico-topográfico
G40 Epilepsia
- Identificação e resumo clínico
Paciente ________________ Registro _________________
Idade ________ Sexo _______ Cor _________
Médico _________________
Procedência do exame (nome do hospital/clínica) _____________________
Resumo clínico _____________________
- Dados clínicos relevantes
II.1 Idade de início das crises epilépticas ____________________
II.2 Tipos de crises e frequência ____________________
II.3 Tempo de refratariedade aos anticonvulsivantes _________________
II.4 Achados de neuroimagem _____________________
II.5 Fez uso de placas de monitoração ou de eletrodos intracranianos?
- Sim
- Não
II.6 Material enviado ___________________
III. Procedimento cirúrgico
- Lesionectomia
- Lobectomia total
- Lobectomia parcial
- Amigdaloipocampectomia
- Desconexão
- Biópsia a céu aberto
- Biópsias estereotáxicas/neuronavegação (especificar número de fragmentos)
- Outro (especificar) ____________________
- Exame macroscópico
IV.1 Dimensões ____ x ____ x ____ cm
IV.2 Peso ____ g
IV.3 Descrição
IV.3.1 Externa
Leptomeninge ________________
Sulcos e giros ________________
IV.3.2 Aos cortes (seccionar perpendicularmente à superfície pial da cúpula do giro ou, no caso de espécime fragmentado, perpendicularmente ao maior eixo)
Espessura geral do córtex ____ mm
Transição córtex-substância branca
- Preservada
- Não preservada
Lesões; se presentes, descrever______________________
Hipocampo, subículo e córtex entorrinal são estruturas localizadas no lobo temporal mesial e denominadas em conjunto como formação hipocampal (Figura 1). Na parte anterior do lobo temporal mesial, adjacente a essas estruturas, encontra-se ainda o corpo amigdaloide (amígdala cerebral).
O termo “hipocampo” é utilizado para descrever conjuntamente duas regiões interligadas do arquicórtex, com três camadas cada: a fascia dentata (“giro denteado”) e o corno de Ammon.
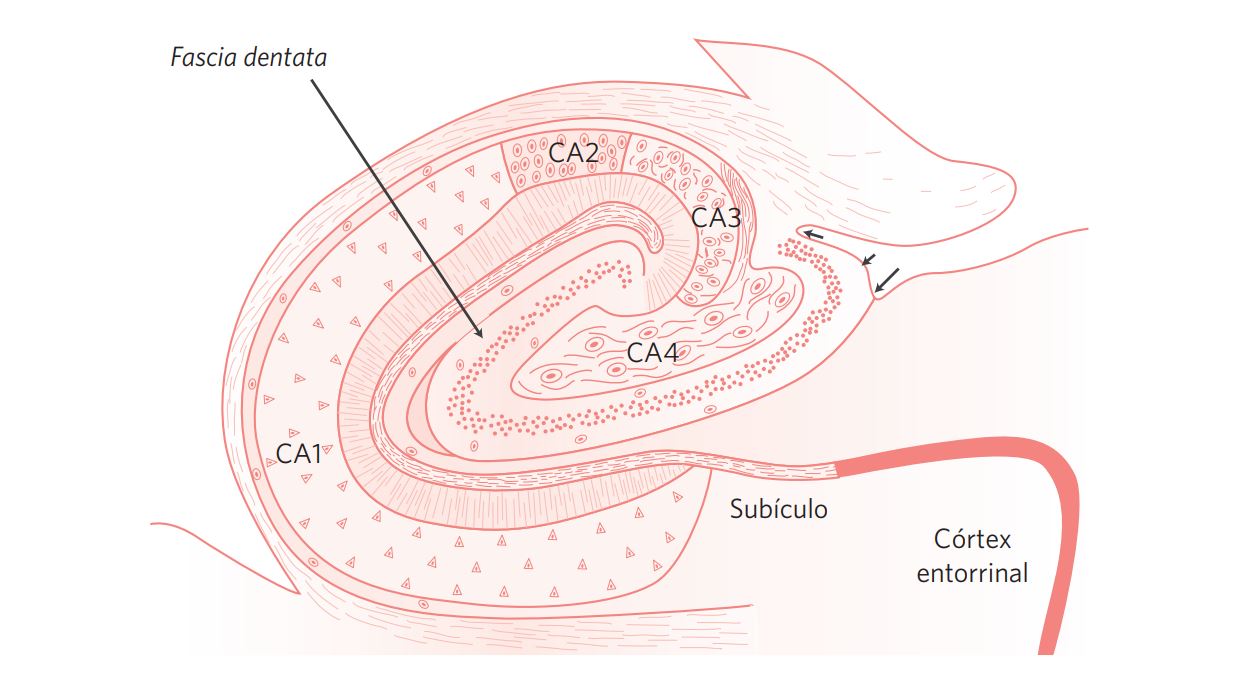
Figura 1 Esquema da arquitetura do hipocampo (fascia dentata e corno de Ammon com os subcampos CA1, CA2, CA3 e CA4), subículo e córtex entorrinal.
IV.4 Hipocampo
- Enviado
- Não enviado
Os hipocampos devem ser sempre seccionados e incluídos no plano coronal.
IV.5 Subículo
- Enviado
- Não enviado
IV.6 Córtex entorrinal
- Enviado
- Não enviado
IV.7 Amígdala (corpo amigdaloide)
- Enviada
- Não enviada
- Exame microscópico
V.1 Neocórtex (córtex de seis camadas)
V.1.1 Arquitetura colunar
- Preservada
- Não preservada
- Presença de microcolunas*
* Nota: Constituída por mais de oito neurônios imaturos (pequenos) alinhados em direção vertical.
V.1.2 Arquitetura laminar
- Preservada
- Não preservada
V.1.3 Neurônios hipertróficos*
- Sim
- Não
V.1.4 Neurônios dismórficos*
- Sim
- Não
V.1.5 Neurônios imaturos (< 250 mcm²)*
- Sim
- Não
V.1.6 Células balonadas (balloon cells)*
- Sim
- Não
* Nota: Para caracterização morfológica das alterações celulares, ver Blümcke et al., 2011.
V.1.7 Heterotopia neuronal na substância branca
- Presente
- Ausente
Se presente, tipo
- Heterotopia nodular
- Heterotopia em banda
- Neurônios isolados
V.1.17 Outras lesões
- Neoplasias (p. ex., neoplasias neuronais/gliais mistas)
Tipo histológico, grau (especificar) ___________________ - Malformações vasculares
- Lesões cicatriciais secundárias a trauma cranioencefálico
- Lesão isquêmica pré-natal ou perinatal
- Encefalite de Rasmussen
- Encefalite límbica
- Infecções bacterianas
- Infecções virais
- Outras (especificar) _________________
V.2.2 Fascia dentata
V.2.2.1 Dispersão de neurônios granulares
- Presente
- Ausente
V.2.2.2 Perda dos neurônios granulares
- Presente
- Ausente
V.2.2.3 Astrogliose
- Presente
- Ausente
V.2.2.4 Corpos amiláceos
- Presentes
- Ausentes
V.2.2.5 Outros (especificar) ___________________
- Diagnóstico final (exemplo)
VI.1 Macroscopia
Recebido em formalina tamponada, produto de lobectomia temporal esquerda constituída por fragmento de cérebro medindo, em suas maiores dimensões, 5,5 x 4 x 1,5 cm, e pesando 45 g. Apresenta-se revestido por leptomeninge delgada e translúcida, notando-se áreas de congestão e hemorragia. Evidencia-se giro aumentado de volume a cerca de 2,5 cm da porção anterior do espécime que, aos cortes, exibe espessamento do córtex, com perda dos limites entre as substâncias branca e cinzenta.
Também foi enviado um pequeno fragmento de hipocampo medindo, nos seus maiores diâmetros, 1,5 x 0,8 x 0,5 cm. O fragmento demonstra consistência firme e, aos cortes, superfície brancacenta, com pequenas áreas de hemorragia recente.
VI.2 Microscopia
Os cortes histológicos corados pela hematoxilina-eosina exibem fragmentos de neocórtex com preservação das arquiteturas colunar e laminar na maior parte do espécime, além de ocasionais corpos amiláceos e gliose subpial (gliose de Chaslin). No espaço subaracnóideo, evidencia-se moderado infiltrado de células linfomononucleares e alguns neutrófilos (placa de monitoração). Observam-se algumas áreas com perda da arquitetura laminar cortical e relativa preservação da colunar, em razão da presença de numerosos neurônios citomegálicos dispersos pelo córtex. Há diversas células balonizadas, além de conspícua astrogliose e focos de microcalcificação distrófica. Chama a atenção a existência de agrupamentos neuronais, inclusive na substância branca subjacente, que apresenta marcada gliose e rarefação de fibras nervosas.
O hipocampo exibe acentuada perda dos neurônios piramidais e astrogliose em CA1, com relativa preservação dos demais setores. Na fascia dentata, há dispersão e discreta perda dos neurônios granulares e astrogliose.
VI.3 Diagnóstico – produto de lobectomia temporal e hipocampectomia parcial esquerda
Córtex temporal com displasia cortical focal tipo IIb (ILAE, 2011).
Esclerose hipocampal.
Assinatura (CRM e data).
VII. Comentários
VII.1 Espécimes de epilepsia sempre devem ser incluídos na sua totalidade, independentemente do número de cassetes resultantes.
VII.2 Os cortes histológicos devem ter espessura de 4 micrômetros e corados: pela hematoxilina-eosina; pelo luxol fast blue (LFB), para avaliar a transição córtex-substância branca; pela imuno-histoquímica para NeuN, para avaliar a arquitetura cortical colunar e laminar; pelo neurofilamento (NF – clone SMI32), para avaliar acúmulo de neurofilamento no citoplasma e orientação da árvore dendrítica para auxiliar na identificação de neurônios dismórficos e hipertróficos; pelo GFAP, para identificar astrócitos reacionais; pelo CD34 (clone QBEnd-10) para pesquisa de precursores neuronais indiferenciados.
VII.3 A esclerose hipocampal é caracterizada por perda neuronal e astrogliose secundária em áreas específicas do hipocampo, como as regiões iniciais (CA1 ou setor de Sommer), e perda variável nos demais setores do hipocampo, com exceção de CA2 (setor resistente), que está relativamente preservado, além de alterações na fascia dentata (perda e/ou dispersão de neurônios granulares e astrogliose). Ver tabela 2 (classificação da esclerose hipocampal).
VII.4 “Esclerose mesial temporal” é a expressão mais apropriada quando há evidências de perda neuronal e gliose em outras estruturas da porção medial do lobo temporal, como subículo, córtex entorrinal e/ou amígdala cerebral.
VII.5 Recentemente, foi proposta pela International League Against Epilepsy (ILAE) uma nova classificação (Tabela 1) das displasias corticais focais (Blümcke et al., 2011), sendo esta a utilizada neste capítulo. Trata-se da primeira classificação obtida por consenso internacional, em substituição à classificação anterior de Palmini et al., 2004.
VII.6 Quando se processam fragmentos maiores de tecido nervoso, isto é, com mais de 1,5 cm², sugere-se maior tempo de processamento histológico do tecido, sobretudo nas passagens de xilol (em razão da grande quantidade de lipídios no tecido). Esse processamento permite cortes melhores.
Tabela 1 Classificação atual das displasias corticais focais.
| DCF tipo I (isolada) | DCF com laminação cortical radial anormal – presença de microcolunas (tipo Ia) | DCF com laminação cortical tangencial anormal (tipo Ib) | DCF com laminação cortical radial e tangencial anormal (tipo Ic) | |
| DCF tipo II (isolada) | DCF com neurônios dismórficos (tipo IIa) | DCF com neurônios dismórficos e células balonadas (tipo IIb) | ||
| DCF tipo III (associada com lesão principal) | Anormalidades da laminação cortical no lobo temporal associadas com esclerose hipocampal (tipo IIIa) | Anormalidades da laminação cortical adjacentes a tumor glioneuronal ou glial (tipo IIIb) | Anormalidades da laminação cortical adjacentes a malformação vascular (tipo IIIc) | Anormalidades da laminação cortical adjacentes a lesão adquirida precocemente na infância* (tipo IIId) |
DCF tipo III (sem outras especificações, SOE): caso a lesão principal suspeitada clinicamente ou radiologicamente não esteja disponível para avaliação microscópica.
DCF: displasia cortical focal.
* Nota: Cicatrizes gliais de origem isquêmica pré-natais ou perinatais e traumáticas, encefalite límbica e de Rasmussen.
Fonte: adaptada de Blümcke et al. ILAE, 2011.
Tabela 2 Classificação atual da esclerose hipocampal (Blümcke et al, 2013).
| Ausência de EH; somente gliose | Apesar do traçado eletrofisológico evidenciar o início das crises no lobo temporal mesial através de eletrodos intraoperatórios, histologicamente o hipocampo não apresenta perda neuronal. Presença de importante gliose reacional evidenciada pelo anticorpo GFAP. |
| EH tipo 1 | Segmento CA1 mais severamente afetado; segmentos CA2, CA3 e CA4 apresentam perda neuronal significativa. |
| EH tipo 2 | Apresentação histopatológica com perda neuronal predominante em CA1. Presença muito discreta de perda neuronal nos outros setores (CA2, CA3 e CA4) |
| EH tipo 3 | Apresentação histopatológica com perda neuronal predominante em CA4. |
EH – Esclerose hipocampal
Parte II Neuropatologia das formas pseudotumorais de doenças desmielinizantes
Código nosológico-topográfico
G35-G37 Doenças desmielinizantes do sistema nervoso central
- Identificação e resumo clínico
- do exame __________________
Paciente _______________ Registro _____________________
Idade ______________ Sexo _____________ Cor ______________
Médico __________________________
Resumo clínico ________________________
- Dados clínicos relevantes, incluindo achados de neuroimagem
__________________________
III. Procedimento cirúrgico
- Biópsia a céu aberto Data ____/____ /____
- Biópsias estereotáxicas/neuronavegação (especificar número de fragmentos) _______________________ Data ____/ ____ /____
- Lesionectomia Data ____/____ /____
- Outro (especificar) _____________________ Data ____/____ /____
- Exame macroscópico (se possível, com a identificação da região anatômica do espécime e/ou correlação radiológica)
IV.1 Dimensões ____ x ____ x ____ cm
IV.2 Peso ____ g
IV.3 Descrição
IV.3.1 Externa
Leptomeninge ______________________
Vasos ______________________
Sulcos e giros ______________________
IV.3.2 Dos cortes (seccionar perpendicularmente à superfície pial da cúpula do giro ou, no caso de espécime fragmentado, perpendicularmente ao maior eixo)
Material enviado
- Substância branca
- Córtex
Se presente, especificar espessura geral do córtex ____ mm
Transição córtex-substância branca
- Preservada
- Não preservada
Lesões; se presentes, descrever _______________________
- Exame microscópico
V.1 Necrose
- Presente
- Ausente
V.2 Axônios no interior da lesão (histoquímica: coloração de Bielschowsky; imuno-histoquímica: neurofilamento)
- Sim
- Não
Caso presentes
- Preservados
- Não preservados
V.3 Desmielinização
- Presente
- Ausente
V.4 Macrófagos
- Presentes
- Ausentes
V.5 Infiltrado inflamatório perivascular
- Presente
- Ausente
Caso presente, descrever, se possível, a imunofenotipagem* ______________________
* Nota: Em geral, em doenças desmielinizantes, infartos e infecções, o infiltrado perivascular é predominantemente constituído por linfócitos T. Na predominância de linfócitos B (CD20+), deve-se considerar linfoma como diagnóstico diferencial.
V.6 Astrogliose
- Presente
- Ausente
V.7 Astrócitos reacionais multimicronucleados (astrócitos de Creutzfeldt) – astrócitos com mitoses granulares*
- Presentes
- Ausentes
* Nota 1: Os astrócitos de Creutzfeldt (não confundir com doença de Creutzfeldt-Jakob) são astrócitos reacionais volumosos com múltiplos núcleos pequenos (micronúcleos) e citoplasma abundante e eosinofílico. A mitose granular é observada em astrócitos reacionais, com citoplasma abundante e eosinofílico, mas que apresentam múltiplos corpos cromatínicos, diminutos e puntiformes. Para alguns, os astrócitos com mitoses granulares são precursores dos astrócitos de Creutzfeldt (Erana-Rojas et al., 2002).
* Nota 2: Embora os astrócitos de Creutzfeldt e os com mitoses granulares sejam achados inespecíficos – podem ser observados em diversos processos, inclusive em gliomas –, são mais frequentemente observados nas doenças desmielinizantes.
- Diagnóstico final (exemplo)
VI.1 Diagnóstico – produto de biópsia de lesão parietal esquerda
Processo desmielinizante, consistente com a forma pseudotumoral da esclerose múltipla (diagnóstico anatomoclínico).
Assinatura (CRM e data).
VII. Comentários
VII.1 As doenças desmielinizantes são mais comuns em mulheres na faixa etária dos 40 anos.
VII.2 Diagnóstico
O diagnóstico de esclerose múltipla depende sempre de correlação clínica, ou seja, é anatomoclínico. Na ausência de informações clínicas e/ou da hipótese clínica de esclerose múltipla, preconiza-se o diagnóstico descritivo de processo desmielinizante e devem-se anotar as possíveis causas a serem investigadas.
VII.3 Biópsia
Nas doenças desmielinizantes, a biópsia (estereotáxica ou a céu aberto) é realizada somente nos casos em que a apresentação radiológica não for típica e mostre lesão sugestiva de neoplasia, podendo ser única ou múltipla.
VII.4 Neuroimagem
As doenças desmielinizantes podem apresentar aspectos radiológicos atípicos, às vezes com captação incompleta de contraste em anel, com efeito de massa, envolvendo a substância branca.
VII.5 Histopatologia
São lesões hipercelulares, ricas em macrófagos, cujos núcleos redondos e citoplasma claro podem simular oligodendrócitos. Microvacuolização citoplasmática (aspecto espumoso) e bordas distintas da membrana celular favorecem o reconhecimento de macrófagos.
Infiltrado linfocitário perivascular rico em linfócitos T e a presença de astrócitos reacionais volumosos também favorecem a doença desmielinizante.
VII.6 Métodos ancilares
No caso de suspeita de doença desmielinizante, deve-se proceder à coloração para mielina (LFB) e axônios (Bielschowsky), como também reações imuno-histoquímicas para neurofilamentos (axônios), GFAP (astrócitos reacionais) e CD68 (macrófagos).
VII.7 Diagnósticos diferenciais (principais)
Infecções, especialmente a leucoencefalopatia multifocal progressiva (LEMP), se o paciente for imunossuprimido, e as neoplasias, como oligodendrogliomas (ver item “VII.5 Histopatologia”).
Lesões vasculares isquêmicas também podem ser ricas em macrófagos, porém há importante perda axonal. Em geral, o aspecto radiológico envolvendo um território vascular é típico, e a lesão envolve também a substância cinzenta, na qual podem ser observados neurônios isquêmicos.
Parte III Procedimentos em biópsias de nervo e músculo
Códigos nosológico-topográficos
G50-G64 Transtornos dos nervos, das raízes e dos plexos nervosos; polineuropatias e outros transtornos do sistema nervoso periférico
G70-G73 Doenças da junção mioneural e dos músculos
- Identificação, resumo clínico e informações gerais
I.1 Nervo: informações gerais
São poucas as neuropatias que podem ser diagnosticadas com o material incluído em parafina (vasculite, hanseníase, amiloidose); por isso, sempre que for solicitada uma biópsia de nervo, deve-se fornecer glutaraldeído a 2,5% para, se necessário, enviar o fragmento assim fixado a um laboratório com recursos para inclusão em resina, a fim de que se realizem cortes semifinos (0,5 a 1 mcm).
Habitualmente, o fragmento de nervo é dividido, uma parte para ser fixada em formalina a 10%, para inclusão em parafina (cortes em HE de 4 mcm); e outra parte, de menor tamanho, para ser fixada por 2 horas em glutaraldeído a 2,5% (estocado gelado a 4o °C), seguido de armazenamento em solução-tampão (PBS, tampão fosfatossalino), para inclusão em resina plástica (cortes semifinos e/ou ultrafinos), conforme as instruções do laboratório especializado.
I.2 Músculo: informações gerais
Uma vez que são poucas as situações em que a biópsia de músculo fixada em formalina permite o diagnóstico (algumas miopatias inflamatórias, infecciosas, atrofias neurogênicas, distrofia, mas sem especificar o tipo, e poucas miopatias congênitas), é fundamental que o músculo seja congelado assim que for retirado ou em poucas horas (desde que mantido resfriado), caso precise ser transportado para um laboratório especializado.
- Dados clínicos relevantes, incluindo achados de eletroneuromiografia
III. Procedimento cirúrgico
Nervo ou músculo amostrado ____________________
- Biópsia incisional Data ____ / ____ /____
- Biópsia excisional (p. ex., gânglio sensitivo) Data ____ /____ /____
- Outro (especificar) _______________ Data ____ /____ /____
- Descrição macroscópica
Dimensões ____ x ____ x ____ mm
Descrição ________________________
Externa ________________________
Superfície de corte* ________________________
* Nota: Maiores detalhes sobre o processamento e a fixação do material são descritos no item “VII. Comentários”, deste capítulo. O segmento de nervo ou o fragmento de músculo fixado em formalina deve ser dividido em duas partes. Uma para inclusão longitudinal e a outra para ser mais uma vez seccionada perpendicularmente no maior eixo (durante a macroscopia ou pelo técnico, no momento da inclusão), obtendo-se assim vários cortes transversais para inclusão da superfície de corte.
Os fragmentos de músculo e nervo devem ser manuseados adequadamente, com delicadeza (não pinçar), inclusive durante o procedimento cirúrgico, para preservar a morfologia e a integridade tecidual e, assim, possibilitar estudos por microscopia óptica, histoquimicoenzimáticos e por microscopia eletrônica.
- Exame microscópico de espécime incluído em parafina
V.1 De nervo
V.1.1 Arquitetura geral do nervo
Epineuro
- Preservado
- Não preservado
Perineuro
- Preservado
- Não preservado
Endoneuro
- Preservado
- Não preservado
V.1.2 Lesões elementares do nervo
Necrose fibrinoide e vasculite comprometendo pequenas artérias, arteríolas, vênulas e capilares do epineuro.
- Presente
- Ausente
Deposição de hemossiderina
- Presente
- Ausente
Proliferação vascular (angiogênese)
- Presente
- Ausente
Infiltrado inflamatório
- Presente
- Ausente
Caso presente, descrever o tipo e a localização (p. ex., no epineuro) ____________________
Deposição de material patológico
- Presente
- Ausente
Caso presente, descrever o tipo (p. ex., amiloide, fibrina, grânulos metacromáticos de cor marrom em cortes congelados obtidos no criostato e corados pelo cresil violeta) e a localização (p. ex., epineuro, perineuro, endoneuro, célula de Schwann) __________________
Degeneração mielinoaxonal
- Presente
- Ausente
Infiltração por macrófagos
- Presente
- Ausente
Perda axonal (avaliada indiretamente pelo aumento do colágeno endoneural – ver item “VII.1.3”)
- Presente
- Ausente
Proliferação de células de Schwann com formação de bulbos de cebola
- Presente
- Ausente
Pesquisa de bacilos álcool-ácido resistentes (coloração de Fite-Faraco)
- Positiva
- Negativa
Caso positiva, descrever a localização (p. ex., em células de Schwann, macrófagos, células perineurais e endoteliais) _____________________
V.2 De músculo
V.2.1 Alterações no tamanho das fibras
- Presentes
- Ausentes
Atrofia (fibras anguladas)
- Presente
- Ausente
Atrofia (fibras arredondadas)
- Presente
- Ausente
Hipertrofia
- Presente
- Ausente
V.2.2 Alterações na forma das fibras
- Presentes
- Ausentes
Poligonais
- Presentes
- Ausentes
Arredondadas
- Presentes
- Ausentes
Angulares
- Presentes
- Ausentes
V.2.3 Alterações citoarquiteturais
V.2.3.1 Posição dos núcleos
Periféricos
- Presentes
- Ausentes
Internalizados
- Presentes
- Ausentes
Centrais e vesiculosos
- Presentes
- Ausentes
Centrais enfileirados
- Presentes
- Ausentes
Picnóticos e aglomerados
- Presentes
- Ausentes
V.2.4 Lesões elementares diversas
Fibras hialinas
- Presentes
- Ausentes
Necrose hialina
- Presente
- Ausente
Regeneração
- Presente
- Ausente
Segmentação (splitting)
- Presente
- Ausente
Degeneração das fibras com afluxo de macrófagos
- Presente
- Ausente
Infiltrado inflamatório
- Presente
- Ausente
Caso presente, descrever o tipo e a localização (p. ex., perivascular, endomisial) _____________________
Fibrose
- Presente
- Ausente
Caso presente, descrever a localização (p. ex., perimisial, endomisial) ____________________
Infiltração adiposa
- Presente
- Ausente
Pesquisa de agentes infecciosos
- Presente
- Ausente
Caso positiva, especificar o tipo (p. ex., Toxoplasma gondii, Trypanosoma cruzi, Cysticercus cellulosae) ___________________
- Diagnóstico (exemplos)
VI.1 Produto de biópsia de nervo sural esquerdo
Neuropatia inflamatória, comprometendo principalmente o espaço subperineural. Ausência de sinais de vasculite. Presença de fibrose endoneural.
A pesquisa minuciosa e sistemática de bacilos álcool-ácido resistentes pela coloração de Fite-Faraco teve resultado negativo*.
* Nota: Embora a pesquisa tenha resultado negativo, não se exclui a possibilidade de hanseníase, que deve ser avaliada clinicamente.
VI.2 Produto de biópsia de músculo bíceps direito
Fragmento de músculo esquelético exibindo numerosas fibras atróficas e anguladas, isoladas ou em grupos. Ausência de afluxo de células inflamatórias.
Nota: Os achados presentes são compatíveis com atrofia neurogênica. No entanto, deve-se correlacionar com os achados do exame histoenzimológico (material congelado) e os demais achados clinicolaboratoriais.
VII. Comentários
VII.1 Nervo
VII.1.1 Nas biópsias de nervo, a amostra deve ter pelo menos 1 a 2 cm de comprimento, para fornecer material suficiente às técnicas histológicas.
VII.1.2 O nervo pode ser fixado totalmente em glutaraldeído ou parte em formalina (avaliação de vasculite, inflamação e amiloidose) e parte em glutaraldeído, devendo ser sempre processado para inclusão em parafina e resina.
VII.1.3 As colorações usuais utilizadas nas biópsias de nervo são hematoxilina e eosina (HE), tricrômico de Gomori ou Masson para avaliação da fibrose endoneural (cujo aumento reflete perda axonal), vermelho congo para material amiloide e os métodos de Wade, Fite-Faraco ou Ziehl-Nielsen para bacilos álcool-ácido resistentes, pela alta prevalência de neuropatia na hanseníase.
VII.1.4 Material incluído em resina plástica (fixado em glutaraldeído a 2,5%): destina-se à avaliação de axônios mielinizados (de grande e pequeno calibres) e da mielina em cortes semifinos e corados com azul de toluidina. Os axônios amielínicos e eventuais inclusões em função do tipo de neuropatia podem ser vistos em cortes ultrafinos, examinados em microscópio eletrônico.
VII.2 Músculo
VII.2.1 A amostra deve ter pelo menos 1 a 2 cm de comprimento para fornecer tecido suficiente às técnicas histológicas, histoenzimológicas, histoquímicas e imuno-histoquímicas.
VII.2.2 Para congelamento da amostra: um fragmento de músculo é montado em cortiça (de modo que se obtenham cortes transversos), envolvido com talco e imerso em nitrogênio líquido (isopentano não é recomendável por ter risco de explosão quando utilizado inadequadamente). Muito rapidamente, após o congelamento (para evitar a formação de cristais), pode ser colocado em criotubo ou embrulhado em papel laminado (já identificado) e estocado em nitrogênio líquido.
VII.2.3 Para o transporte da amostra, o mais seguro é acondicioná-la em criotubo imerso em gelo seco.
Em necrópsias, sempre que houver história de doença neurológica, devem ser amostrados, além do SNC, fragmentos de músculos (bíceps, quadríceps femoral, etc.) e segmentos do sistema nervoso periférico, como raízes nervosas espinhais, cauda equina, gânglios espinhais e porções do plexo braquial e lombar. O nervo sural também pode ser obtido por dissecção adicional.
Parte IV Procedimentos em espécimes com suspeita de doença causada por príon
Código nosológico-topográfico
A81 Infecções virais atípicas do sistema nervoso central*
* Nota: Embora seja causada por uma proteína infectante e não por vírus, a doença priônica está classificada pelo CID-10 entre as infecções virais atípicas.
- Bases neuropatológicas das doenças causadas por príon
I.1 Macroscopia
- Atrofia cortical difusa, envolvendo cérebro e cerebelo.
I.2 Microscopia
- Perda neuronal.
• Espongiose.
• Gliose.
I.3 Positividade imuno-histoquímica para proteína priônica patológica (PrPsc)
I.4 Particularidades fenotípicas
- Placas amiloides.
• Tipos de placas.
• Topografia das placas.
Observação 1: O principal risco no manuseio dos tecidos biopsiados é a inoculação direta do tecido infectado e a contaminação de superfícies mucosas e dos olhos.
Observação 2: A doença priônica é sistêmica. As partículas infectantes (proteína alterada, PrPsc) são encontradas, além do SNC, em grande quantidade em tecidos ricos em células do sistema monociticofagocitário (fígado, baço, etc.).
Tecidos fixados em formalina e glutaraldeído continuam sendo infectantes.
- Manuseio dos tecidos e métodos de descontaminação
- Todo material descartável deve ser destruído por incineração.
• Os instrumentos e as superfícies podem ser descontaminados por imersão ou aplicação de hidróxido de sódio 2N por 1 hora.
• A vidraria deve ser limpada com hipoclorito de sódio 20.000 ppm por 1 hora.
• Instrumentos também podem ser descontaminados em autoclave a 135°C por um ciclo único de 18 minutos ou 6 ciclos sucessivos de 3 minutos cada.
• Fragmentos do encéfalo devem ser fixados em formalina.
Os tecidos podem deixar de ser infectantes se fragmentos de 5 mm de espessura forem imersos em ácido fórmico a 96% por 1 hora.
- Após a desinfecção em ácido fórmico a 96% (1 hora), os tecidos podem ser processados e cortados em micrótomos convencionais, mas o técnico deve sempre usar luvas, e as navalhas devem ser descartáveis.
Observação: No caso de blocos de parafina com tecido que não sofreu o tratamento de descontaminação, a superfície do bloco que contém o fragmento deve ser colocada em solução de ácido fórmico a 96% por 1 hora.
III. Comentários gerais
III.1 A alteração espongiforme, a perda neuronal e a gliose são fortemente sugestivas de doenças causadas por príon, como a doença de Creutzfeldt-Jakob. No entanto, alterações semelhantes às espongiformes podem ser secundárias às perdas neuronais acentuadas, ou até mesmo a artefatos de fixação, de forma que a detecção da PrPsc no tecido através de imuno-histoquímica é imperativa para a confirmação diagnóstica.
III.2 É importante informar ao cirurgião que a biópsia deve ser representativa do córtex cerebral, e não da substância branca.
A doença priônica é de notificação compulsória.
Bibliografia
Aronica E, Becker AJ, Spreafico R. Malformations of cortical development. Brain Pathol 2012; 22(3):380-401.
Bleggi-Torres LF, Noronha L. Músculos esqueléticos. In: Brasileiro-Filho G (ed.). Bogliolo patologia. 8. ed. Rio de Janeiro: Guanabara Koogan, 2011.
Blümcke I, Mühlebner A. Neuropathological work-up of focal cortical dysplasias using the new ILAE consensus classification system – practical guideline article invited by the Euro-CNS Research Committee. Clin Neuropathol 2011; 30(4):164-77.
Blümcke I, Thom M, Aronica E, et al. International consensus classification of hippocampal sclerosis in temporal lobe epilepsy: A Task Force report from the ILAE Commission on Diagnostic Methods. Epliepsia 2013; 54(7):1315-1329.
Blümcke I, Thom M, Aronica E, Armstrong DD, Vinters HV, Palmini A et al. The clinicopathologic spectrum of focal cortical dysplasias: a consensus classification proposed by an ad hoc Task Force of the ILAE Diagnostic Methods Commission. Epilepsia 2011; 52(1):158-74.
Chimelli L. Nervos periféricos. In: Brasileiro-Filho G (ed.). Bogliolo patologia. 8. ed. Rio de Janeiro: Guanabara Koogan, 2011.
Coras R, de Boer OJ, Armstrong D, Becker A, Jacques TS, Miyata H et al. Good interobserver and intraobserver agreement in the evaluation of the new ILAE classification of focal cortical dysplasia. Epilepsia 2012; 53(8):1341-8.
Ellison D, Love S, Chimelli LMC, Harding B, Lowe JS, Vinters HV et al. Neuropathology: a reference text of CNS pathology. 3. ed. St Louis: Mosby, 2013.
Erana-Rojas IE, Barboza-Quintana A, Ayala AG, Fuller GN. Demyelinating pseudotumor. Ann Diagn Pathol 2002; 6(5): 265-71.
Louis D, Reifenberger G, Brat DJ, Ellison DW. Tumours: introduction and neuroepithelial tumours. In: Love S, Louis D, Ellison DW (eds.). Greenfield’s neuropathology. 8 ed. London: Hodder Arnold, 2008.
Palmini A, Najm I, Avanzini G, Babb T, Guerrini R, Foldvary-Schaefer N et al. Terminology and classification of the cortical dysplasias. Neurology 2004; 62(6 Suppl 3):S2-8.
Voltar para a página inicial do manual