Lucas Faria Abrahão Machado
Felipe D’Almeida Costa
Isabela Werneck da Cunha
Renée Zon Filippi
Roberto Falzoni
Códigos de topografia (CiD-10*)
C44 Neoplasias malignas da pele (não-melanoma)
C44.0 Neoplasia maligna da pele do lábio
C44.1 Neoplasia maligna da pele da pálpebra, incluindo o canto
C44.2 Neoplasia maligna da pele da orelha e do conduto auditivo externo
C44.3 Neoplasia maligna da pele de outras partes e de partes não especificadas da face
C44.4 Neoplasia maligna da pele do couro cabeludo e do pescoço
C44.5 Neoplasia maligna da pele do tronco
C44.6 Neoplasia maligna da pele do membro superior, incluindo ombro
C44.7 Neoplasia maligna da pele do membro inferior, incluindo quadril
C44.8 Neoplasia maligna da pele com lesão invasiva
C44.9 Neoplasia maligna da pele, não especificada
C45 Mesotelioma
C46 Sarcoma de Kaposi
C47 Neoplasia maligna dos nervos periféricos e do sistema nervoso autônomo
C48 Neoplasia maligna de retroperitônio e peritônio
C49 Neoplasia maligna do tecido conjuntivo e partes moles. Inclui vaso sanguíneo, bursa, cartilagem (exceto articular, laríngea e nasal), fáscia, gordura, ligamento (exceto uterino), vaso linfático, músculo, sinóvia e bainha tendinosa
C49.0 Tecido conjuntivo e partes moles de face, cabeça e pescoço (incluindo ouvido e pálpebra)
C49.1 Tecido conjuntivo e partes moles do membro superior, incluindo ombro
C49.2 Tecido conjuntivo e partes moles do membro inferior, incluindo quadril
C49.3 Tecido conjuntivo e partes moles de tórax, axila, diafragma, grandes vasos (exceto: coração – C38.0; mediastino – C38.1 a C38.3; e timo – C37)
C49.4 Tecido conjuntivo e partes moles do abdome, parede abdominal e hipocôndrio
C49.5 Tecido conjuntivo e partes moles da pelve, nádega, virilha e períneo
C49.6 Tecido conjuntivo e partes moles do tronco, não especificado
C49.8 Lesão sobreposta de tecido conjuntivo e partes moles (neoplasia maligna de tecido conjuntivo e partes moles, cujo sítio de origem não possa ser classificado em qualquer uma das categorias C47 a C49.6)
C49.9 Tecido conjuntivo e partes moles, não especificado
D48.1 Neoplasia de comportamento incerto ou desconhecido do tecido conjuntivo e outros tecidos moles (tecido conjuntivo da orelha e pálpebra)
D48.2 Neoplasia de comportamento incerto ou desconhecido dos nervos periféricos e do sistema nervoso periférico
D48.3 Neoplasia de comportamento incerto ou desconhecido do retroperitônio
D48.4 Neoplasia de comportamento incerto ou desconhecido do peritônio
D48.5 Neoplasia de comportamento incerto ou desconhecido da pele
*Uma nova versão atualizada da Classificação Estatística Internacional de Doenças e Problemas Relacionados à Saúde (CID-11) foi lançada como uma pré-visualização em 18 de junho de 2018 para permitir que os Estados Membros se preparem para a implementação, incluindo a tradução da CID para seus idiomas nacionais. Esta pré-visualização já se encontra disponível no site da Organização Mundial da Saúde (OMS), porém a CID-11 entrará em vigor em 1º de janeiro de 2022.
I. Identificação e resumo clínico
II. Dados clínicos relevantes
- Idade e sexo ___________________
- Local do tumor:
- Cabeça e pescoço (especificar, se possível)
- Órbita (especificar, se possível)
- Tronco e extremidades (especificar, se possível)
- Retroperitônio (especificar, se possível)
- Órgãos viscerais abdominais (especificar, se possível)
- Órgãos viscerais torácicos (especificar, se possível)
- Tamanho e número do(s) tumor(es) (dados referidos em exames radiológicos ou informação clínica): ___________________
- Achados clínicos, radiológicos e cirúrgicos ___________________
- Diagnósticos prévios ___________________
- Tratamento atual ou prévio ___________________
- Doenças concomitantes, síndromes ou história familiar ________________
III. Procedimento cirúrgico
- Punção aspirativa por agulha fina
- Biópsia
- Biópsia por agulha grossa
- Biópsia incisional (com ou sem pele)
- Biópsia excisional (com ou sem pele)
- Ressecção cirúrgica*
- Ressecção intralesional
- Ressecção marginal
- Ressecção ampla
- Ressecção radical
* Definição dos tipos de ressecção cirúrgica:
Ressecção intralesional: O tumor (macroscópico ou microscópico) não é removido totalmente. Exérese parcial ou curetagem são exemplos ou quando um tumor microscópico é deixado na margem acidentalmente em uma tentativa de ressecção marginal.
Ressecção marginal: Remoção do tumor e sua pseudocápsula com uma quantidade não significante de tecido adjacente. Não há tumor macroscópico na margem; no entanto, existe maior possibilidade de presença de tumor microscópico. Se um foco microscópico é identificado na margem, então trata-se de uma ressecção intralesional. Observe que ocasionalmente um cirurgião realiza uma biópsia “excisional” que efetivamente alcança o mesmo resultado de uma ressecção marginal. Esse termo não se aplica aos tumores sem pseudocápsula e difusamente infiltrativos em tecidos adjacentes, como fibromatose de tipo desmoide e dermatofibrossarcoma protuberans.
Ressecção ampla: Uma ressecção intracompartimental. O tumor é removido com pseudocápsula e um filete amplo de tecido normal ao redor da neoplasia, mas sem a remoção completa de todo um grupo muscular, compartimento ou osso.
Ressecção radical: A remoção de todo um compartimento de tecidos moles (por exemplo, compartimento anterior da coxa, quadríceps) ou osso, ou a excisão dos grupos musculares adjacentes, se o tumor for extracompartimental, além de produto de amputações.
IV. EXAME MACROSCÓPICO
O exame macroscópico de espécimes de sarcomas é uma etapa muito importante para o início do correto diagnóstico histopatológico, avaliação de margens cirúrgicas e estimativa de resposta às terapias pré-operatórias (neoadjuvantes) eventualmente empregadas.
A neoplasia deve ser representada na proporção de um corte por centímetro, incluindo áreas heterogêneas e a relação da mesma com as demais estruturas presentes no espécime (i.e., pele, músculo, osso adjacente, feixe vásculo-nervoso, etc.). Uma estimativa da porcentagem da presença de necrose macroscópica deve ser registrada. Nos casos onde a estimativa macroscópica excede a microscópica, a maior porcentagem deve ser reportada no laudo e utilizada para fins de graduação.
As margens cirúrgicas mais próximas devem ser representadas através de cortes perpendiculares, com suas respectivas distâncias à neoplasia anotadas. Para margens próximas com distância inferior a 2,0 cm, sugere-se que uma representação adequada seja de 6 a 8 cortes perpendiculares, com o objetivo de não deixar de amostrar uma possível margem microscópica positiva. Margens positivas, ainda que microscopicamente, constituem-se em um importante fator de risco para recorrências locorregionais em sarcomas de partes moles, requerendo com frequência ampliação de margens e/ou radioterapia complementar (adjuvante).
Não há consenso em relação ao protocolo mais adequado para o exame de peças cirúrgicas submetidas à quimioterapia neoadjuvante, entretanto esquemas de avaliação semelhantes aos de osteossarcoma e sarcoma de Ewing podem ser empregados. Deve ser escolhida a fatia mais representativa da neoplasia, mapeando-a através de desenho esquemático, fotografia ou fotocópia, com a identificação da topografia de onde foi amostrado cada bloco. As porcentagens de celularidade viável devem ser estimadas em cada corte, com a celularidade residual global resultando de uma média aritmética. De uma forma geral, resposta patológica maior é aquela onde a neoplasia residual está presente em até 10% da amostra. Neste conceito inclui-se a resposta patológica completa, quando não há celularidade tumoral viável residual.
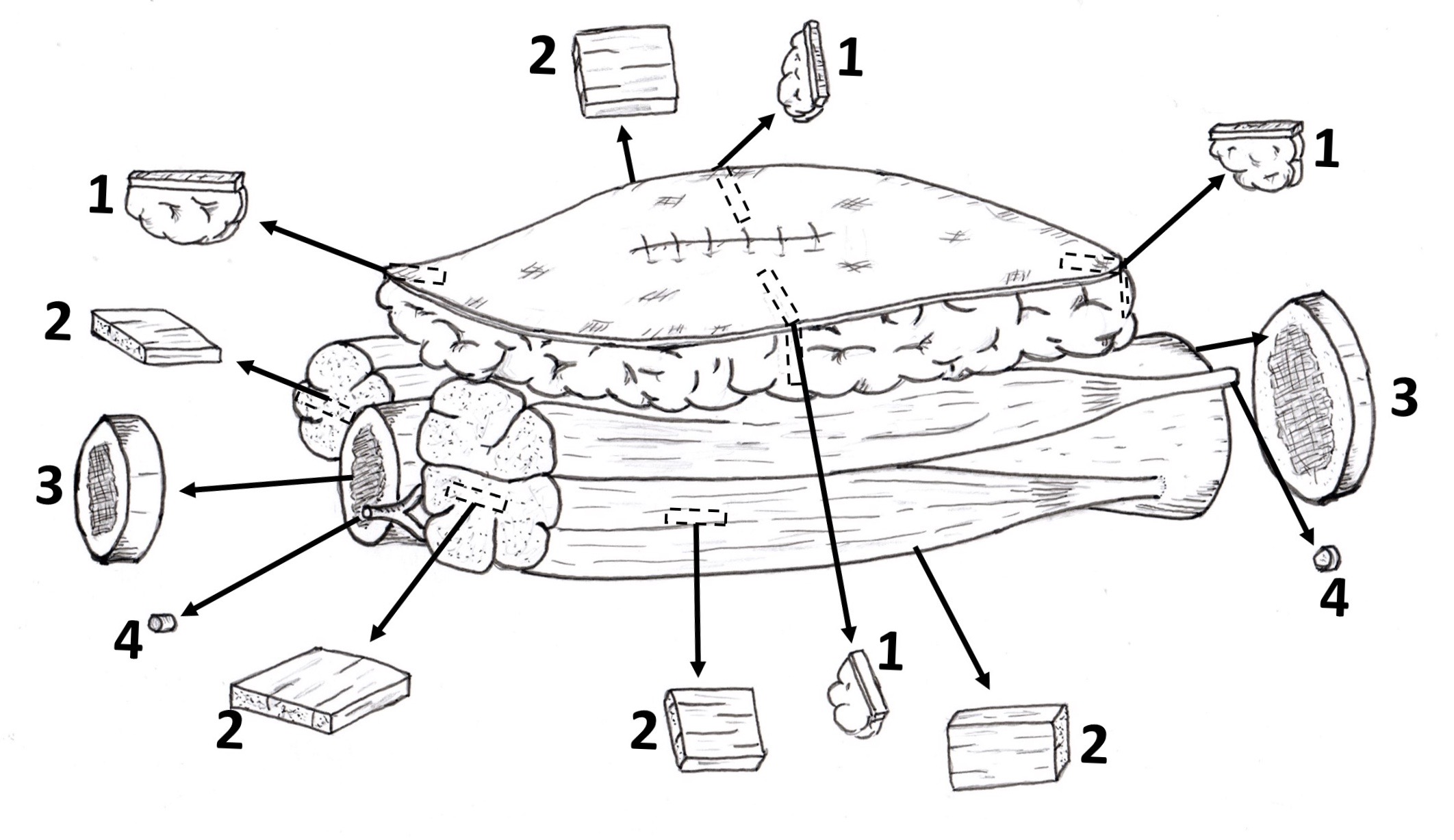
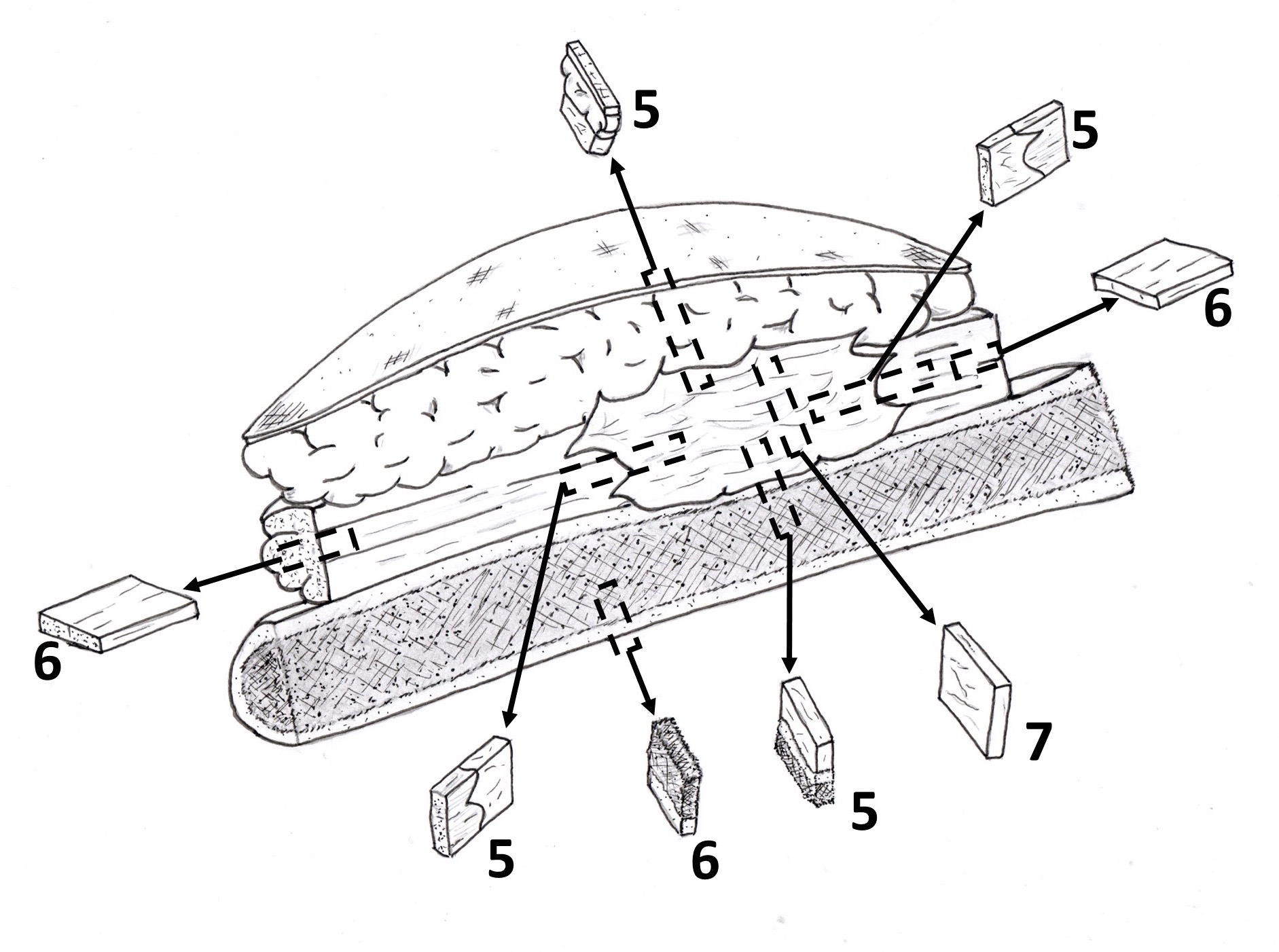
1 – Margens de pele
2 – Margens de partes moles (músculo e partes moles)
3 – Margens de osso (corte transversal)
4 – Margens vasculares, neurais e de tendão
5 – Cortes dos limites da neoplasia com estruturas adjacentes
6 – Cortes de estruturas adjacentes ao tumor
7 – Cortes do tumor
Figura 1. Esquema da amostragem tecidual no exame macroscópico de uma ressecção radical de tumor de partes moles
*Recomendações para amostragem tecidual de tumores mesenquimais cutâneos:
- Realizar cortes transversais (independentemente do tamanho da peça)
- Submeter toda a fatia dividida de acordo com o tamanho
- Evitar cortes que seccionem o tumor ao meio
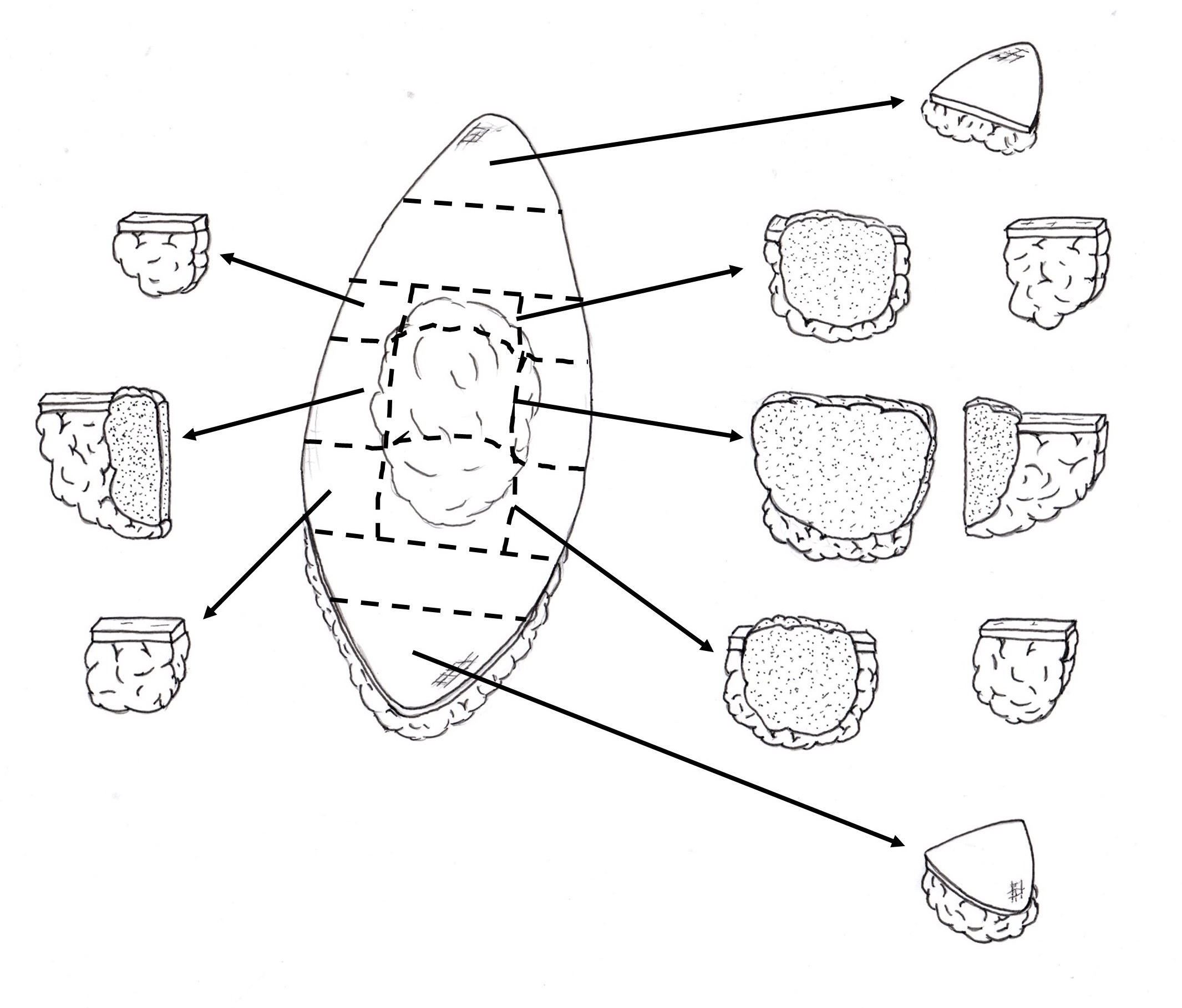
Figura 2. Esquema da amostragem tecidual no exame macroscópico de uma ressecção de tumor mesenquimal cutâneo
V. EXAME MICROSCÓPICO
- 1. Tipo histológico (classificação da OMS de tumores de partes moles) ___________________
* Nota: Nem sempre é possível classificar precisamente os tumores em amostras teciduais pequenas, especialmente em material de biópsia por agulha. Embora os patologistas devam fazer esforços para classificar os tumores em pequenas amostras, ocasionalmente só é possível a estratificação em categorias diagnósticas básicas (como linfoma, carcinoma, melanoma e sarcoma). Em alguns casos, a classificação definitiva de um sarcoma só é possível em material de biópsias abertas ou produtos de ressecção cirúrgica e, ocasionalmente, através de consultoria de patologista especialista em tumores de partes moles.
- 2. Grau Histológico (FNCLCC: Grupo de Sarcomas dos Centros de Câncer da Federação Francesa) (tabelas 1 e 2):
- Grau 1
- Grau 2
- Grau 3
- Sarcoma não graduável (vide nota 1)
- Amostra insuficiente para graduação (vide nota 2)
Tabela 1 Graduação dos sarcomas de adultos, segundo a FNCLCC, modificada pela OMS (2013).
| Diferenciação tumoral | |
| Escore 1 | Sarcomas semelhantes ao tecido adulto normal |
| Escore 2 | Sarcomas diferentes do tecido adulto normal, porém com diferenciação identificável ou tipos histológicos específicos (Tabela 2) |
| Escore 3 | Sarcomas indiferenciados, com diferenciação não definida, de tipo histológico incerto, sarcomas embrionários e tipos histológicos específicos (Tabela 2) |
| Contagem mitótica | |
| Escore 1 | 0 a 9 mitoses/10 CGA |
| Escore 2 | 10 a 19 mitoses/10 CGA |
| Escore 3 | 20 ou mais mitoses/10 CGA |
| Necrose tumoral | |
| Escore 0 | Ausência de necrose |
| Escore 1 | Necrose inferior a 50% do tumor |
| Escore 2 | Necrose igual ou superior a 50% do tumor |
| Graduação Final | |
| Grau 1 (G1) | Escore total 2 ou 3 |
| Grau 2 (G2) | Escore total 4 ou 5 |
| Grau 3 (G3) | Escore total 6, 7 ou 8 |
* Nota 1: Não é recomendado graduar rabdomiossarcoma embrionário e alveolar, condrossarcoma mixóide extra-esquelético, sarcoma alveolar de partes moles, sarcoma de células claras, sarcoma epitelioide e angiossarcoma. Apesar de não serem graduados, estes tumores são considerados para fins terapêuticos como sarcomas de alto grau. A graduação do tumor maligno da bainha do nervo periférico é controversa. Embora a maioria dos casos sejam considerados como de alto grau, essa entidade pode ter exemplos de baixo grau ou categorias de potencial biológico incerto de malignidade ainda em debate na literatura. O tumor estromal gastrointestinal (GIST) não é graduado e possui classificação própria de risco, assim como os leiomiossarcomas uterinos que possuem critérios de malignidade diferentes dos leiomiossarcomas somáticos convencionais.
* Nota 2: A graduação precisa exige uma amostra adequada de tecido, o que nem sempre está disponível nas amostras de PAAF ou biópsias por agulha ou em tumores previamente tratados com radiação ou quimioterapia. No entanto, dada a importância da graduação no estadiamento e tratamento, recomenda-se em amostras escassas pelo menos separar os sarcomas em baixo e alto grau.
* Nota 3: A 8ª edição do sistema de estadiamento do Comitê Conjunto Americano para o Câncer (AJCC) e da União Internacional contra o Câncer (UICC) recomenda o sistema de três graus da FNCLCC. Entretanto, para fins de separação em grupos do estadiamento (estádios da doença; I a IV), geralmente realizada pelos oncologistas ou cirurgiões oncológicos, os tumores grau 1 são considerados de BAIXO GRAU e os tumores graus 2 e 3 como ALTO GRAU.
* Nota 4: Atualmente é recomendado que lipossarcomas mixoides com mais de 5% de áreas hipercelulares ou de células redondas sejam considerados como de alto grau, pois este parâmetro tem impacto prognóstico significante, mesmo na ausência de alto índice mitótico e necrose.
Tabela 2. Escores específicos de diferenciação tumoral
| Tipo Histológico | Escore de diferenciação |
| Leiomiossarcoma bem diferenciado | 1 |
| Tumor lipomatoso atípico/Lipossarcoma bem diferenciado | 1 |
| Lipossarcoma mixoide | 2 |
| Leiomiossarcoma convencional | 2 |
| Tumor maligno convencional da bainha do nervo periférico | 2 |
| Mixofibrossarcoma | 2 |
| Lipossarcoma mixoide de alto grau (“células redondas”) | 3 |
| Lipossarcoma desdiferenciado | 3 |
| Lipossarcoma pleomórfico | 3 |
| Leiomiossarcoma pleomórfico | 3 |
| Sarcoma sinovial | 3 |
| Tumor maligno da bainha do nervo periférico com diferenciação heteróloga rabdomioblástica (tumor maligno de Triton) | 3 |
| Osteossarcoma extraesquelético | 3 |
| Condrossarcoma mesenquimal | 3 |
| Sarcoma pleomórfico indiferenciado (ou de células fusiformes) | 3 |
Modificado de Fletcher CDM, Bridge JA, Hogendoorn PCW, et al, eds: WHO classification of tumours of soft tissue and bone. Lyon, France, 2013, IARC Press.
V.3. Índice mitótico: _________________ (10 CGA)
A contagem de mitoses é feita na área mais mitoticamente ativa, longe de áreas de necrose, em 10 campos de grande aumento (CGA) consecutivos. Recomenda-se fazer a média de pelo menos 5 sequências de 10 CGA.
V.4. Necrose:
- Ausente
- Presente (especificar porcentagem, sobretudo se igual ou inferior a 50% ou superior a 50%) _________________%
* Nota: Para efeito de graduação, usar porcentagem de necrose preferencialmente obtida no exame macroscópico. Alternativamente, a informação para quantificação de necrose também pode ser obtida de laudos de exames radiológicos.
V.5. Margens cirúrgicas:
- Livres de neoplasia (se possível, especificar a margem mais próxima e a distância)
- Comprometida(s) por sarcoma (especificar)
- Não avaliáveis
V.6. Linfonodos regionais:
- Ausentes
- Presentes (especificar número de linfonodos comprometidos e livres de neoplasia)
V.7. Dados adicionais:
- Invasão vascular angiolinfática
- Infiltração perineural
- Invasão de outras estruturas (especificar)
- Alterações teciduais associadas à tratamento
VI. ESTADIAMENTO (pTNM, AJCC 8a Edição, 2017)
A 8ª edição do manual de estadiamento do Comitê Conjunto Americano de Câncer (AJCC) enfatiza bastante o local primário anatômico dos sarcomas de partes moles, devido às particularidades de recorrência local e riscos de doença metastática. Sistemas de estadiamento separados foram desenvolvidos para sarcomas de partes moles das extremidades e tronco, retroperitônio, cabeça e pescoço e vísceras. Nos dois primeiros locais, os prognósticos são bem caracterizados e bons modelos preditivos baseados em dados de estadiamento estão disponíveis. No entanto, para os dois últimos locais anatômicos, os dados são mais limitados e os sistemas de estadiamento propostos servem como um ponto de partida para refinar a avaliação de riscos. Além disso, foram feitas alterações no sistema de estadiamento AJCC para sarcomas orbitais.
- Tumor primário (pT)
Cabeça e pescoço
___ pTX: O tumor primário não pode ser avaliado
___ pT1: Tumor ≤ 2 cm
___ pT2: Tumor > 2 a ≤4 cm
___ pT3: Tumor > 4 cm
___ pT4: Tumor com invasão de estruturas adjacentes
___ pT4a: Tumor com invasão orbital, base do crânio/invasão dural, invasão de vísceras do compartimento central, envolvimento de ossos da face ou invasão dos músculos pterigoides
___ pT4b: Tumor com invasão do parênquima cerebral, envolvimento circunferencial da artéria carótida, invasão de músculo pré-vertebral ou envolvimento do sistema nervoso central via disseminação perineural
Tronco e extremidades
___ pTX: O tumor primário não pode ser avaliado
___ pT0: Sem evidência de tumor primário
___ pT1: Tumor de 5 cm ou menos na maior dimensão
___ pT2: Tumor maior que 5 cm e menor ou igual a 10 cm na maior dimensão
___ pT3: Tumor maior que 10 cm e menor ou igual a 15 cm na maior dimensão
___ pT4: Tumor com mais de 15 cm na maior dimensão
Órgãos viscerais abdominais e torácicos
___ pTX: O tumor primário não pode ser avaliado
___ pT1: Confinado ao órgão
___ pT2: Extensão do tumor para tecido além do órgão
___ pT2a: Invade serosa ou peritônio visceral
___ pT2b: Extensão além da serosa (mesentério)
___ pT3: Invade outro órgão
___ pT4: Envolvimento multifocal
___ pT4a: Multifocal (2 sítios)
___ pT4b: Multifocal (3-5 sítios)
___ pT4c: Multifocal (> 5 sítios)
Retroperitônio
___ pTX: O tumor primário não pode ser avaliado
___ pT0: Sem evidência de tumor primário
___ pT1: Tumor de 5 cm ou menos na maior dimensão
___ pT2: Tumor maior que 5 cm e menor ou igual a 10 cm na maior dimensão
___ pT3: Tumor maior que 10 cm e menor ou igual a 15 cm na maior dimensão
___ pT4: Tumor com mais de 15 cm na maior dimensão
Órbita
___ pTX: O tumor primário não pode ser avaliado
___ pT0: Sem evidência de tumor primário
___ pT1: Tumor ≤ 2 cm na maior dimensão
___ pT2: Tumor > 2 cm na maior dimensão, sem invasão das paredes ósseas ou globo ocular
___ pT3: Tumor de qualquer tamanho com invasão das paredes ósseas
___ pT4: Tumor de qualquer tamanho com invasão de estruturas do globo ou periorbitais, incluindo pálpebra, conjuntiva, fossa temporal, cavidade nasal, seios paranasais e/ou sistema nervoso central
- Linfonodos regionais (pN) (apenas se há linfonodos submetidos para análise)
___ pN0: Ausência de metástase em linfonodo regional
___ pN1: Metástase regional em linfonodos
* Quando não há linfonodos presentes, a categoria patológica de ‘N’ não é atribuída (o pNX não é usado para tumores de partes moles) e não deve ser relatada.
- Metástase à distância (pM) (apenas se confirmada patologicamente)
___ pM1: Metástase distante
Especifique o(s) sítio(s), se conhecido:
- Descritores TNM (se aplicável) (selecione todas as opções aplicáveis)
___ m (múltiplo)
___ r (recorrente)
___ y (pós-tratamento)
* Nota 1: Devido ao impacto limitado da profundidade no prognóstico e à incapacidade inerente de usar este parâmetro em locais anatômicos que não sejam extremidades e tronco, profundidade não é mais usado na 8ª edição do manual de estadiamento da AJCC. Ressalta-se que tumores mesenquimais restritos a derme e sem penetração na hipoderme usualmente apresentam excelente prognóstico, mesmo com parâmetros histológicos usualmente associados a sarcomas de alto grau. Em algumas entidades desse grupo, o tumor não recebe nem denominação de sarcoma, como é o caso do fibroxantoma atípico (em contraste com sarcoma pleomórfico dérmico, quando há penetração na hipoderme) e tumor muscular liso dérmico atípico (em contraste com leiomiossarcomas hipodérmicos).
* Nota 2: O sistema de estadiamento aplica-se a todos os sarcomas de partes moles das extremidades e tronco, abdômen e órgãos viscerais torácicos e retroperitônio, exceto sarcoma de Kaposi, tumores estromais gastrointestinais (GIST), fibromatose (tumor desmóide) e fibrossarcoma infantil. O sistema de também aplica-se a todos os sarcomas de partes moles da cabeça e pescoço, exceto angiossarcoma, rabdomiossarcoma dos subtipos embrionário e alveolar, sarcoma de Kaposi e dermatofibrossarcoma protuberans (DFSP). Além disso, os sarcomas que surgem dentro dos limites da dura-máter, incluindo o cérebro, não são idealmente estadiados por este sistema.
* Nota 3: Como já descrito na nota 3 do item V.2 (Grau Histológico), para fins de classificação em grupos de estadiamento pelos oncologistas e cirurgiões, os tumores grau 1 são considerados como BAIXO GRAU e os tumores graus 2 e 3 como ALTO GRAU.
VII. ESTUDOS COMPLEMENTARES
- Imuno-histoquímica (especificar) _________________
- Patologia Molecular (especificar) _________________
VII.1. Exame Imuno-Histoquímico
O estudo imuno-histoquímico é uma análise integrada das expressões de vários antígenos em painel. Esta análise nunca é separada da interpretação de dados histológicos convencionais. Portanto, é fundamental que o patologista tenha acesso à quantidade suficiente de tecido para análise histológica convencional a fim de escolher quais marcadores devem ser utilizados em cada caso. Informação clínica e radiológica e diagnósticos prévios também são de grande importância para o raciocínio diagnóstico e escolha do painel imuno-histoquímico. Em contrapartida, vários tumores de partes moles têm características histológicas tão específicas que não necessitam de estudos complementares para seu diagnóstico.
Representatividade da amostra, reagentes, métodos de recuperação antigênica, condições pré-analíticas e técnicas de amplificação de sinal alteram de forma significativa a imunoexpressão e devem ser do conhecimento do patologista ao interpretar os resultados.
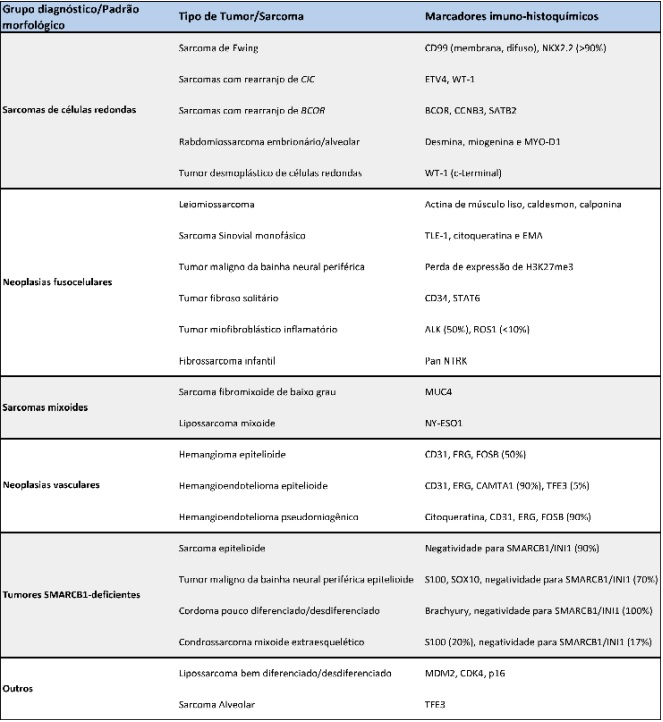
Tabela 3. Exemplos de marcadores imuno-histoquímicos para diagnóstico de tumores de partes moles/sarcomas
VII.2. PATOLOGIA MOLECULAR
Os testes de diagnóstico molecular permitem a identificação de alterações específicas através da análise de DNA e expressão gênica, realizadas por modernas técnicas de sequenciamento, hibridização e PCR em amostras emblocadas em parafina ou congeladas.
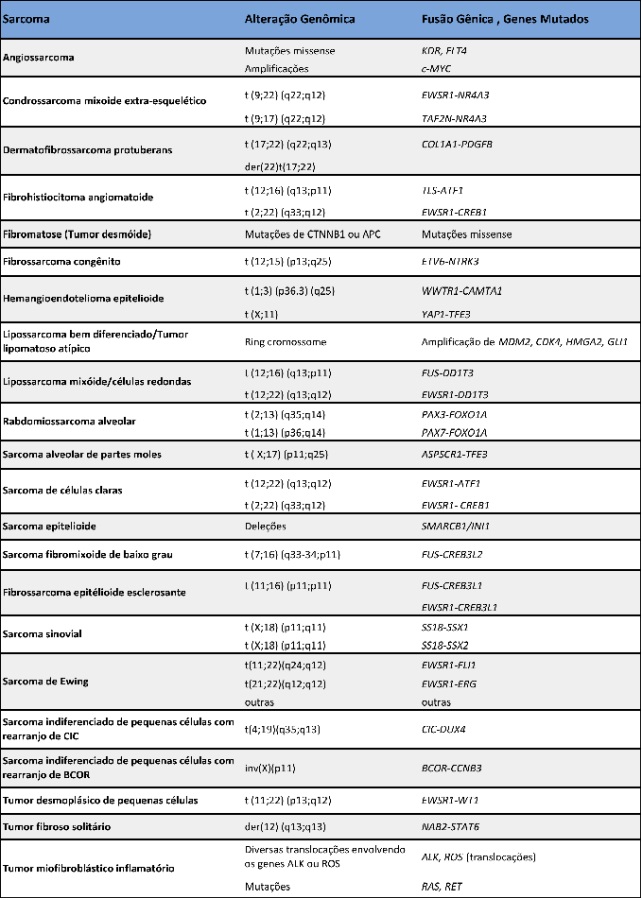
Do ponto de vista molecular, os sarcomas podem ser divididos em dois grupos principais: aqueles que carregam alterações moleculares específicas e aqueles com alterações cariotípicas complexas. Com a evolução do conhecimento e aprimoramento das técnicas moleculares, cada vez mais alterações específicas estão sendo identificadas nos sarcomas, fazendo com que o primeiro grupo não pare de crescer. As 3 principais alterações moleculares descritas em tumores de partes moles são translocações (ex: sarcoma sinovial, sarcoma de Ewing), mutações específicas (ex: fibromatose) e amplificações (ex: lipossarcoma bem diferenciado). A pesquisa destas alterações moleculares pode ser extremamente útil no diagnóstico quando morfologia e imuno-histoquímica não são suficientes para a completa subtipagem. Atualmente, com o advento de novas drogas alvo, o diagnóstico de certeza de alguns subtipos de sarcoma é fundamental para a terapia correta. As principais alterações moleculares podem ser vistas na tabela abaixo:
Tabela 4. Alterações moleculares e citogenéticas dos tumores de partes moles
VIII. CONSIDERAÇÕES GERAIS
Em síntese, no diagnóstico dos tumores de partes moles é absolutamente necessário, sempre que possível, fornecer ao cirurgião ou oncologista os seguintes dados:
- Classificação histológica (OMS).
- Grau histológico (FNCLCC).
- Dimensões da neoplasia.
- Localização e estruturas invadidas pela neoplasia.
- Presença ou ausência de necrose tumoral (quantificar).
- Estado das margens cirúrgicas.
- Estadiamento patológico.
- Estudos complementares, se disponíveis.
IX DIAGNÓSTICO FINAL
IX.1. EXEMPLO 1:
Produto de ressecção de tumor na coxa direita:
- Lipossarcoma mixoide.
- Grau histológico (FNCLCC): 1 (baixo grau).
- Tamanho: 4,5 x 3,0 x 2,5 cm.
- Local: coxa direita.
- Necrose: ausente.
- Índice mitótico: 2/10 CGA.
- Invasão angiolinfática: não detectada.
- Invasão perineural: não detectada.
- Margem cirúrgica: livre de neoplasia (ressecção marginal – área mais próxima dista 0,3 cm).
- Estadiamento patológico (TNM, AJCC 8a edição): pT1.
IX.2. EXEMPLO 2:
Biópsia por agulha grossa de tumor de retroperitônio:
- Sarcoma fusocelular/pleomórfico de alto grau (vide nota).
- Grau histológico (FNCLCC): 3 (alto grau).
- Tamanho: não informado.
- Local: retroperitônio.
- Necrose: presente em menos de 50% do fragmento.
- Índice mitótico: 21/10 CGA.
Nota: É necessário estudo imuno-histoquímico para determinação da histogênese e melhor classificação da neoplasia. Caso haja interesse neste tipo de exame, favor entrar em contato com o laboratório.
IX.3. EXEMPLO 3:
Produto de ressecção de tumor da perna esquerda:
- Mixofibrossarcoma.
- Grau histológico (FNCLCC): 2 (alto grau).
- Tamanho: 8,0 x 5,5 x 4,0 cm.
- Local: perna esquerda.
- Necrose: presente (menos de 50% da neoplasia).
- Índice mitótico: 8/10 CGA.
- Invasão angiolinfática: não detectada.
- Invasão perineural: não detectada.
- Margem cirúrgica inferior: comprometida pela neoplasia.
- Demais margens cirúrgicas livres de neoplasia.
- Estadiamento patológico (TNM, AJCC 8a edição): pT2.
X. REFERÊNCIAS BIBLIOGRÁFICAS
- Cates MM, Cates JMM. Surgical resection margin classifications for high-grade pleomorphic soft tissue sarcomas of the extremity or trunk: definitions of adequate resection margins and recommendations for sampling margins from primary resection specimens. Mod Pathol. 2019 Oct;32(10):1421-1433.
- Laurini JA, Cooper K, Fletcher CDM, Folpe AL, Gannon FH, Hunt JL, et al. Protocol for the examination of specimens from patients with soft tissue tumors. [CAP Web site]; 2019. https://documents.cap.org/protocols/cp-other-softtissue-resection-19-4011.pdf.
- Brierley JD, Gospodarowicz MK, Wittekind C, et al, eds. TNM Classification of Malignant Tumours. 8th ed. Oxford, UK: Wiley; 2016.
- Fletcher CDM, Bridge JA, Hogendoorn PCW, Mertens F, eds. WHO Classification of Soft Tissue and Bone Tumors. 4th ed. Geneva, Switzerland: WHO Press; 2013.
- Amin MB, Edge SB, Greene FL, et al, eds. AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer; 2017.
- Schaefer, Inga-Marie, Gregory M. Cote and Jason L Hornick. “Contemporary Sarcoma Diagnosis, Genetics, and Genomics.” Journal of clinical oncology : official journal of the American Society of Clinical Oncology 36 2 (2018): 101-110 .
- Neuville A, Chibon F, Coindre JM. Grading of soft tissue sarcomas: from histological to molecular assessment. Pathology. 2014 Feb;46(2):113-20.
