Evandro Sobroza de Mello e Luiz Antônio Rodrigues de Freitas
Códigos de topografia
C24 Neoplasia maligna de outras partes, e de partes não especificadas das vias biliares
C24.0 Vias biliares extra-hepáticas
C24.1 Ampola de Vater
C24.8 Lesão invasiva das vias biliares
C24.9 Via biliar, não especificada
Introdução
O presente protocolo pode ser utilizado em carcinomas das vias biliares peri-hilares e de ductos biliares extra-hepáticos distais. Tumores com localização proximal em relação à junção do ducto cístico com o ducto hepático comum e externos ao fígado são denominados tumores peri-hilares. Tumores que comprometem simultaneamente os ductos biliares peri-hilares e os ductos biliares intra-hepáticos são considerados tumores combinados intra-hepáticos e peri-hilares. Tumores que se localizam entre a junção do ducto cístico com o hepático comum e a ampola de Vater são designados tumores do colédoco ou de ductos biliares extra-hepáticos distais. Tumores localizados no ducto cístico são agrupados aos tumores da vesícula biliar para fins de estadiamento e são considerados no Capítulo 44 – Neoplasias da vesícula biliar.
I. Identificação do paciente
II. Resumo clínico
II.1 Informações clínicas relevantes
- Colite ulcerativa
- Doença de Crohn
- Colangite esclerosante primária
- Anomalia na junção colédoco-pancreática
- Cisto de colédoco
- Complexo de von Meyenburg
- Outras doenças de mal formação de placa ductal
- Litíase biliar
- Outras (especificar) ____________
II.2 Estudos radiológicos
Informações relevantes (dilatações, estenoses, cistos, anomalias na junção colédoco-pancreática) ____________
III. Procedimento cirúrgico
- Cirurgia de Whipple (duodenopancreatectomia)
- Ressecção de segmento de ducto biliar
- Ressecção hilar e hepática
- Ressecção de cisto de colédoco
- Outro (especificar) ____________
IV. Avaliação macroscópica
IV.1 Estruturas incluídas no espécime cirúrgico (ver Comentário VIII.1)
- Fígado (especificar) ____________
- Ducto hepático direito
- Ducto hepático esquerdo
- Junção entre os ductos hepáticos direito e esquerdo
- Ducto hepático comum
- Ducto cístico
- Vesícula biliar
- Colédoco
- Pâncreas (especificar) ____________
- Duodeno (especificar) ____________
- Estômago (especificar) ____________
- Outros órgãos (especificar) ____________
IV.2 Padrão macroscópico (ver Comentário VIII.2)
- Formador de massa (nodular)
- Infiltrativo periductal
- Predominantemente intraductal (polipoide)
- Outro (especificar) ____________
IV.3 Tamanho do tumor ___ x ___ x ___ cm
- Não pode ser avaliado
V. Avaliação microscópica
V.1 Tipo histológico (ver Comentário VIII.3)
- Neoplasia intraductal papilar de alto grau
- Neoplasia intraepitelial biliar de alto grau
- Adenocarcinoma (SOE)
- Adenocarcinoma tipo biliar
- Adenocarcinoma tipo gástrico foveolar
- Adenocarcinoma tipo intestinal
- Adenocarcinoma mucinoso
- Adenocarcinoma de células claras
- Adenocarcinoma de células em anel de sinete
- Carcinoma escamocelular
- Carcinoma adenoescamoso
- Neoplasia mucinosa cística com carcinoma invasivo associado
- Carcinoma indiferenciado
- Carcinoma neuroendócrino, tipo de grandes células
- Carcinoma neuroendócrino, tipo de pequenas células
- Carcinoma adenoneuroendócrino
- Carcinossarcoma
V.2 Grau de diferenciação histológico (ver Comentário VIII.4)
- Não determinado
- Grau 1 – Bem diferenciado
- Grau 2 – Moderadamente diferenciado
- Grau 3 – Pouco diferenciado
- Grau 4 – Indiferenciado
V.3 Extensão da infiltração do tumor (ver Comentário VIII.3)
V.3.1 Tumor peri-hilar
- Carcinoma in situ
- Tumor limitado à parede do ducto biliar
- Tumor além do ducto biliar infiltrando tecido adiposo circunjacente
- O tumor invade o parênquima hepático adjacente
- O tumor invade o ramo unilateral da veia porta
- O tumor invade o ramo unilateral da artéria hepática
- O tumor invade a veia porta principal ou seus ramos bilaterais
- O tumor invade a artéria hepática comum
- O tumor invade ramos biliares de segunda ordem bilaterais
- O tumor invade ramo biliar de segunda ordem unilateral com envolvimento de veia porta ou artéria hepática contralateral
V.3.2 Tumor em colédoco (ducto biliar distal)
- Carcinoma in situ
- Tumor limitado à parede do ducto biliar
- O tumor invade além do ducto até o tecido adiposo circunjacente
- O tumor invade órgãos adjacentes (vesícula biliar, fígado, pâncreas, duodeno ou outros) _________ (especificar)
- O tumor invade o tronco celíaco ou a artéria mesentérica superior
V.3.2.1
Profundidade da extensão do tumor
- Sem invasão (neoplasia in situ)
- Tumor invade <5mm
- Tumor invade 5-12mm
- Tumor invade >12mm
V.4 Margens cirúrgicas (ver Comentário VIII.6)
V.4.1 Para ressecções segmentares de tumores peri-hilares ou de colédoco
- Não avaliáveis
- Margens cirúrgicas livres de neoplasia
- Menor distância da margem livre ____ mm (especificar margem do colédoco, ducto hepático comum, ducto hepático direito, ducto hepático esquerdo, margem do colédoco proximal ou distal, outra não especificada) __________
- Margem comprometida por neoplasia in situ (especificar a margem do colédoco, ducto hepático comum, ducto hepático direito, ducto hepático esquerdo, margem do colédoco proximal ou distal, outra não especificada) ___________
- Margem comprometida por neoplasia invasiva (especificar margem do colédoco, ducto hepático comum, ducto hepático direito, ducto hepático esquerdo, outra margem do colédoco proximal ou distal não especificada) __________
- Margem radial livre _____mm (especificar margem do colédoco, ducto hepático comum, ducto hepático direito, ducto hepático esquerdo, margem do colédoco proximal ou distal, outra não especificada) __________
- Margem radial comprometida (especificar margem do colédoco, ducto hepático comum, ducto hepático direito, ducto hepático esquerdo ou margem do colédoco) __________
V.4.2 Para ressecções de tumores hilares com hepatectomia parcial
Além da avaliação descrita em V.4.1
Margem do fígado:
- Não avaliável
- Margem livre da neoplasia. A neoplasia dista da margem ___mm
V.4.2 Tumores de colédoco, ressecção pancreatoduodenal
Além da avaliação descrita em V.4.1
- Não avaliáveis
- Margens cirúrgicas livres de neoplasia
- Menor distância da margem livre ____ mm (especificar a margem) _____________
- Margem comprometida por neoplasia in situ (especificar a margem, colédoco e/ou pancreática) _____________
- Margem comprometida por neoplasia invasiva (especificar margem, colédoco, gástrica ou duodenal, duodeno distal, processo uncinado do pâncreas) _____________
V.5 Invasão vascular angiolinfática
- Não detectada
- Presente
V.6 Infiltração perineural (ver Comentário VIII.7)
- Não detectada
- Presente
V.7 Avaliação dos linfonodos (ver Comentário VIII.8)
- Quantidade de linfonodos avaliados _____________
- Quantidade de linfonodos comprometidos pela neoplasia _____________
V.8 Presença de doença de base
- Colangite crônica, SOE
- Litíase intra-hepática
- Colangite esclerosante primária
- Doenças de malformação de placa ductal
- Hamartomas biliares (complexos de von Meyenburg)
- Doença/síndrome de Caroli
- Cistos hepáticos (caracterizar) _____________
- Doença policística
- Cirrose (especificar o padrão/doença de base) _____________
- Outras (especificar) _____________
V.9 Presença de lesão pré-neoplásica
- Neoplasia intraepitelial biliar (BilIN-1, BilIN-2 ou BilIN-3)
- Neoplasia papilífera intraductal
- Tipo pancreatobiliar
- Tipo intestinal
- Tipo oncocítico
- Tipo gástrico
VI. Diagnóstico final (exemplo)
Produto de pancreatoduodenectomia com: adenocarcinoma de tipo intestinal, moderadamente diferenciado de colédoco, padrão infiltrativo periductal, comprometendo toda a espessura do ducto e estendendo-se ao tecido adiposo periductal.
Tamanho do tumor: 1 x 0,5 x 0,4 cm.
Margens cirúrgicas: livres de neoplasia invasiva com menor distância do tumor de 1,5 cm.
Margem do ducto hepático comum comprometida por neoplasia in situ.
Infiltrações vasculares e perineural: não detectadas.
Metástase para seis de oito linfonodos examinados. TNM: pT2a pN1 pMx.
VII. Classificação TNM dos carcinomas de ductos biliares extra-hepáticos
VII.1 Carcinomas de ductos biliares extra-hepáticos peri-hilares (Tabela 1)
T – Tumor primário
- pTx – Tumor primário não avaliável
- pT0 – Sem evidências de tumor
- pTis – Carcinoma in situ (neoplasia intraepitelial biliar de alto grau ou neoplasia papilar intraductal de alto grau)
- pT1 – Tumor confinado ao ducto biliar com extensão até a camada muscular ou até o tecido fibroso
- pT2 – Tumor invade além da parede do ducto biliar, comprometendo o tecido adiposo circunjacente, ou o fígado adjacente até o tecido adiposo circunjacente
- pT2b – O tumor invade o fígado adjacente
- pT3 – O tumor invade ramos unilaterais da veia porta ou da artéria hepática
- pT4 – O tumor invade a veia porta principal ou seus ramos bilateralmente; ou a artéria hepática comum; ou os ductos biliares de segunda ordem de um lado com envolvimento contralateral da veia porta ou da artéria hepática
N – Linfonodos regionais
- pNx – Linfonodos regionais não podem ser avaliados
- pN0 – Linfonodos regionais livres de metástases
- pN1 – Um a três linfonodos regionais comprometidos (linfondos do hilo, ducto cístico, colédoco, artéria hepática, pancreatoduodenal posterior e veia porta)pN2 –
- pN2 – Quatro ou mais linfonodos regionais comprometidos
M – Metástases a distância
- pM0 – Sem metástases a distância
- pM1 – Com metástases a distância
– se possível, especificar local
Tabela 1 Estadiamento dos carcinomas de ductos biliares extra-hepáticos peri-hilares.
| Estádio | T | N | M |
|---|---|---|---|
| 0 | Tis | N0 | M0 |
| I | T1 | N0 | M0 |
| II | T2a ou T2b | N0 | M0 |
| IIIA | T3 | N0 | M0 |
| IIIB | T4 | N0 | M0 |
| IIIC | Qualquer T | N1 | M0 |
| IVA | Qualquer T | N2 | M0 |
| IVB | Qualquer T | Qualquer N | M1 |
VII.2 Carcinomas de ductos biliares extra-hepáticos distais (Tabela 2)
T – Tumor primário
- pTx – Tumor primário não avaliável
- pTis – Carcinoma in situ (neoplasia intraepitelial biliar de alto)
- pT1 – Tumor invade a parede em profundidade menor que 5mm pT2 – Tumor invade a parede em profundidade entre 5-12 mm
- pT3 – Tumor invade a parede em profundidade maior que 12 mm
- pT4 – O tumor invade o tronco celíaco, a artéria mesentérica superior e/ou a artéria hepática comum
N – Linfonodos regionais
- pNx – Linfonodos regionais não podem ser avaliados
- pN0 – Linfonodos regionais livres de metástases
- pN1 – Um a três linfonodos regionais com metástases
- pN2 – Quatro ou mais linfonodos regionais com metástase
M – Metástases a distância
- pM1 – Com metástases a distância, especificar o local , se possível __________
Tabela 2 Estadiamento dos carcinomas de ductos biliares extra-hepáticos distais.
| Estádio | T | N | M |
|---|---|---|---|
| 0 | Tis | N0 | M0 |
| I | T1 | N0 | M0 |
| IIA | T2
T1 |
N0
N1 |
M0 ou
M0 |
| IIB | T3
T2 ou T3 |
N0
N1 |
M0 ou
M0 |
| IIIA | T1, T2, T3 | N2 | M0 |
| IIIB | T4 | Qualquer N | M0 |
| IV | Qualquer T | Qualquer N | M1 |
VIII. Comentários
VIII.1 Anatomia da via biliar extra-hepática
As informações quanto as estruturas incluídas no espécime cirúrgico devem ser fornecidas pelo cirurgião integrada com a avaliação macroscópica. Um esquema básico da anatomia das vias biliares extra-hepáticas pode ser visto na Figura 1.
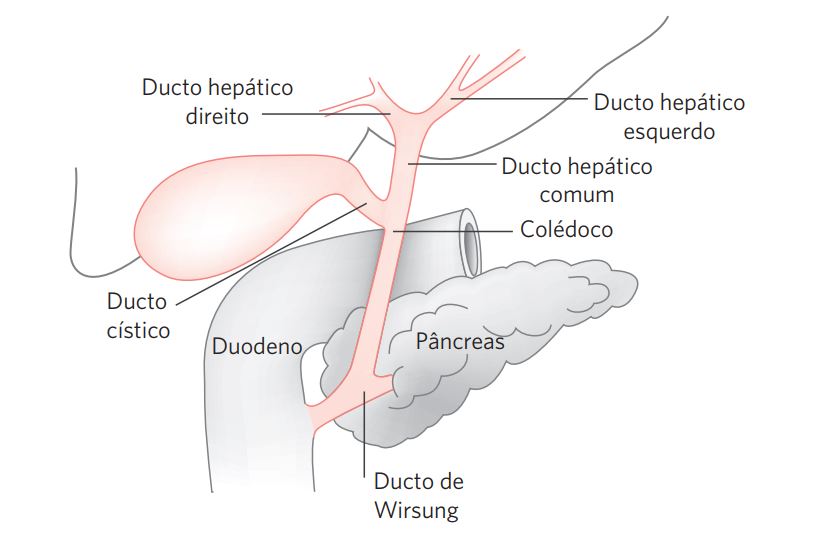
Figura 1 Anatomia das vias biliares extra-hepáticas.
VIII.2 Tipos macroscópicos
Os carcinomas de vias biliares extra-hepáticas podem ser classificados em três tipos macroscópicos: (1) tipo formador de massa: é o tipo mais frequente nos colangiocarcinomas intra-hepáticos, mas ocasionalmente pode ser visto nos tumores extra-hepáticos; ; (2) tipo infiltrativo periductal: o tumor infiltra-se difusamente ao longo da parede do segmento de ducto biliar acometido; (3) tipo intraductal: é um tipo mais raro em nosso meio, em que a lesão cresce sob a forma de um pólipo para o interior do ducto, podendo ser infiltrativa em sua base de implantação.
VIII.3 Tipos histológicos
Os tipos histológicos correspondem aos recomendados pela OMS (2010). Em relação ao prognóstico, os tumores papilares e os adenocarcinomas SOE, tipos intestinal e mucinoso, formam um grupo intermediário, enquanto os tumores com células em anel de sinete, sarcomatoide e de células claras têm comportamento mais agressivo.
VIII.4 Graduação histológica
Os critérios para estabelecer os graus de diferenciação histológica dependem dos tipos histológicos. Quando os tumores são adenocarcinomas do tipo intestinal, podem ser adotados os critérios sugeridos para adenocarcinomas SOE proposto para tumores de cólon e reto pela OMS (2010). O grau nuclear e a arquitetura são levados em consideração nos outros adenocarcinomas. Os carcinomas escamocelulares são classificados segundo os critérios adotados em outros órgãos e tecidos (Broders, 1932). A gradução deve levar em consideração a área menos diferenciada da neoplasia
VIII.5 Extensão da infiltração do tumor
A extensão da neoplasia (o quanto invade a parede dos ductos biliares) é um fator prognóstico relevante. A diferença de recidiva entre tumores classificados como T1 e T2 é significativa. Considera-se extensão além do ducto biliar quando há infiltração do tecido adiposo adjacente. Tumores precoces são aqueles limitados à parede dos ductos e são frequentemente polipoides.
VIII.6 Margens cirúrgicas
O comprometimento de margem é um fator relevante em recidivas e na sobrevida geral. Com frequência, os tumores são multicêntricos e se associam a carcinomas in situ de grande extensão.
VIII.7 Infiltração perineural
Os dados sobre o significado prognóstico de invasão perineural são contraditórios. Há referência à relação prognóstica com invasão perineural extramural ou do plexo nervoso pancreático.
VIII.8 Comprometimento de linfonodos
Há diferenças significativas de sobrevida quando não há comprometimento de linfonodos, quando 1 a 3 linfonodos estão comprometidos ou quando 4 ou mais linfonodos têm metástases.
VIII.9 Imunofenótipo
Os adenocarcinomas de via biliar são classicamente positivos para citoqueratina 7, antígeno carcinoembrionário (CEA) e antígeno de membrana epitelial (EMA). Também é bem conhecida a positividade para citoqueratinas de alto peso molecular (p. ex., as marcadas pelo clone 34betaE12), como outros adenocarcinomas de padrão ductal, o que pode ser útil para diferenciação com metástases do trato digestivo ou ginecológico, por exemplo. Além disso, muitos dos colangiocarcinomas de vias biliares extra-hepáticas são positivos para MUC2 e para MUC5AC, em contraste com os intra-hepáticos e quase todos são positivos para MUC1.
VIII.10 Patologia molecular
O número de estudos publicados ainda é pequeno, mas as alterações moleculares mais frequentemente descritas em colangiocarcinomas extra-hepáticos são vistas nos genes KRAS, P53, CDKN2A/B, SMAD4 and STK1. As alterações que são mais comumente vistas nos tumores intra-hepáticos (IDH1, BAP1 e FGFR2) são raras nas neoplasias extra-hepáticas. Das alterações genéticas suscetíveis a terapias alvo-específicas, a mais frequente é a amplificação do HER-2 (3-8% na maior parte dos estudos), mas casos isolados com alterações no PIK3CA, MET, BRAF e NTRK também foram relatados. A frequência de casos com instabilidade de microssatélites é baixa, mas estudos preliminares com imunoterapia são suficientemente promissores para alguns oncologistas requisitarem a realização do teste. Em conclusão, ainda não há nenhuma recomendação formal para realização de testes moleculares em casos de rotina, mas os laboratórios são ocasionalmente solicitados para realização de exames específicos ou de painéis de genes em casos de neoplasia avançada, em que a abordagem terapêutica convencional já não tenha funcionado.
IX.Bibliografia
Albores-Saavedra J, Adsay NV, Crawford JM, Tsui WMS et al. Tumors of the gallbladder and extrahepatic bile ducts. In: Bosman FT, Carneiro F, Hruban RH, Theise ND (eds.). WHO classification of tumors of the digestive system. 4. ed. Lyon: IARC, 2010.
Albores-Saavedra J, Murakata L, Krueger JE, Henson DE. Noninvasive and minimally invasive papillary carcinomas of the extrahepatic bile ducts. Cancer 2000; 89:508-15.
American Joint Committee on Cancer. Perhilar Bilue Duct. In: AJCC Cancer StagingManual. 8th ed. New York, NY: Springer; 2017: 311-316.
American Joint Committee on Cancer. Distal Bile Duct. In: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer; 2017: 317-325.
Broders AC. Carcinoma in situ contrasted with benign penetrating epithelium. JAMA 1932; 99:1670-4.
Cha JM, Kim MH, Leey SK, Seo DW, Lee SS, Lee JH et al. Clinicopathological review of 61 patients with early bile duct cancer. Clinical Oncol 2006; 18, 669-77.
Chung YJ, Choi DW, Choi SH, Heo JS, Kim DH. Prognostic factors following surgical resection of distal bile duct cancer. J Korean Surg Soc. 2013;85(5):212-218.
DeOliveria ML, Cunningham SC, Cameron JL, Kamangar F, Winter JM, Lillemoe KD et al. Cholangiocarcinoma: thirty-one-year experience with 564 patients at a single institution. Ann Surg 2007; 245:755-62.
Fava G, Lorenzini I. Molecular pathogenesis of cholangiocarcinoma. Int J Hepatol 2012; 2012:630543.
Hong SM, Cho H, Lee J, Ro JY. The number of metastatic lymph nodes in extrahepatic bile duct carcinoma as a prognostic factor. Am J Surg Pathol 2005; 29:1177-83.
Hong SM, Cho H, Moskalu CA, Yu E. Measurement of the invasion depth of extrahepatic bile duct carcinoma: an alternative method overcoming the current t classification problems of the AJCC staging system. Am J Surg Pathol 2007; 31:199-206.
Hong SM, Kim HJ, Pi DY, Jo D, Cho HJ, Yu E et al. Analysis of extrahepatic bile duct carcinomas according to the new american joint committee on cancer staging system focused on tumor classification problems in 222 patients. Cancer 2005; 104(4):802-10.
Jarnagin WR. Cholangiocarcinoma of the extrahepatic bile ducts. Semin Surg Oncol 2000; 19:156-76.
Kakar, S; Shi, C; Berlin, J; Fitzgibbons, D.K.P. ; Frankel, W.L. ; Krasinskas, A. M.; Mino-Kenudson, M; Pawlik, T.; Vauthey, J.N; Washington, M. K . Protocol for the Examination of Specimens from Patients With Carcinoma of the Distal Extrahepatic Bile Ducts. College of American Patologists: https://documents.cap.org/protocols/cp-distal-extrahepatic-bile-ducts-2017-v4000.pdf
Kakar, S; Shi, C; Berlin, J; Fitzgibbons, D.K.P. ; Frankel, W.L. ; Krasinskas, A. M.; Mino-Kenudson, M; Pawlik, T.; Vauthey, J.N; Washington, M. K. Protocol for the Examination of Specimens From Patients With Carcinoma of the Perihilar Bile Ducts. College of American Patologists. https://documents.cap.org/protocols/cp-perihilar-bileducts-17protocol-4001 (1)
Tyson GL, El-Serag HB. Risk factors for cholangiocarcinoma. Hepatology 2011; 54(1):173-84.
Lowery MA, Ptashkin R, Jordan E, Berger MF, Zehir A, Capanu M, Kemeny NE,O’Reilly EM, El-Dika I, Jarnagin WR, Harding JJ, D’Angelica MI, Cercek A,Hechtman JF, Solit DB, Schultz N, Hyman DM, Klimstra DS, Saltz LB, Abou-Alfa GK. Comprehensive Molecular Profiling of Intrahepatic and Extrahepatic Cholangiocarcinomas: Potential Targets for Intervention. Clin Cancer Res. 2018;24(17):4154-4161.
Wellner UF, Shen Y, Keck T, Jin W, Xu Z. The .survival outcome and prognostic factors for distal cholangiocarcinoma following surgical resection: a meta-analysis for the 5-year survival. Surg Today. 2017, 47(3):271-279.
Winkelmann R, Schneider M, Hartmann S, Schnitzbauer AA, Zeuzem S,Peveling-Oberhag J, Hansmann ML, Walter D. Microsatellite Instability Occurs Rarely in Patients with Cholangiocarcinoma: A Retrospective Study from a German Tertiary Care Hospital. Int J Mol Sci. 2018;19(5):1421.
Zen Y, Adsay NV, Bardadin K, Colombari R, Ferrell L, Haga H et al. Biliary intraepithelial neoplasia: an international interobserver agreement study and proposal for diagnostic criteria. Mod Pathol 2007; 20(6):701-9.
Zen Y, Fujii T, Itatsu K, Nakamura K, Minato H, Kasashima S et al. Biliary papillary tumors share pathological features with intraductal papillary mucinous neoplasm of the pancreas. Hepatology 2006; 44(5):1333-43.
Voltar para a página inicial do manual
