Autora
Ana Leticia Boff
Dermapat, Laboratório de Dermatopatologia, Porto Alegre (RS), Brasil
1. Indicações de exame histopatológico
- Alopecias cicatriciais
- Alopecias não-cicatriciais com dúvida diagnóstica ou refratárias ao tratamento
2. Realizando a biópsia
2.1 Escolha do local da biópsia
2.1.1 Alopecia difusa
Nos casos de alopecia difusa (p.ex.: alopecia androgenética, alopecia areata difusa e eflúvio telógeno), uma única amostra da região parietal, ou local de maior acometimento, é geralmente suficiente. A dermatoscopia deve ajudar a guiar o local da biópsia. A região frontal anterior deve ser evitada nos casos suspeitos de alopecia androgenética versus eflúvio telógeno devido à miniaturização fisiológica existente nessa topografia. Área com pontos pretos e área de ponto de exclamação na dermatoscopia deve ser escolhida na suspeita de alopecia areata difusa.
Nos casos suspeitos de alopecia fibrosante em padrão de distribuição (FAPD), pode ser realizada amostra com punch para se obter uma área com alteração dermatoscópica mais evidente associada à área de miniaturização (região parietal, vértice ou coroa).
2.1.2 Alopecia localizada / em placa
O local mais apropriado para se biopsiar uma placa é a borda, preferencialmente a área que contenha ainda alguns folículos e com indícios clínicos de inflamação, tais como eritema e hiperceratose peripilar (Fig. 1).
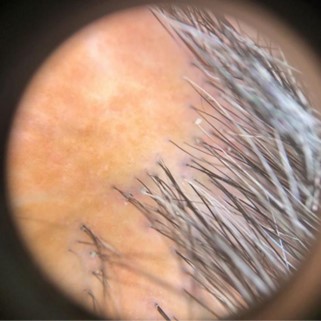
Fig. 1. Borda de placa de alopecia com inflamação apresentando eritema e hiperceratose peripilar: local ideal para a amostragem.
Deve-se evitar biopsiar o centro da placa de alopecia para que a amostra não inclua apenas unidades foliculares já substituídas por colágeno ou tratos já fibróticos (Fig. 2).
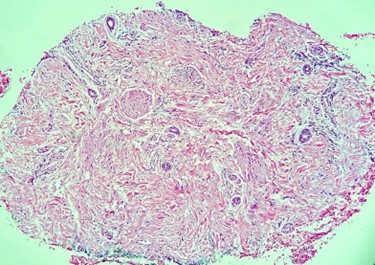
Fig. 2. Centro de placa de alopecia cicatricial: ausência de unidades foliculares.
O centro de uma placa pode ser biopsiado apenas na dúvida clínica entre alopecia cicatricial e alopecia areata, pois mostrará ou depleção das unidades foliculares nas alopecias cicatriciais, ou folículos miniaturizados e telógenos na alopecia areata.
Nos casos de alopecia com retração da linha de implantação, o ideal é obter amostra um pouco mais posterior à linha de implantação, na área de eritema ou hiperceratose peripilar, ou que contenha fio distrófico ou ponto preto à dermatoscopia.
2.2 Quantidade de amostras
Em geral um punch é suficiente, o qual deverá ser incluído preferivelmente em corte horizontal. Os cortes histológicos horizontais mostraram-se superiores aos cortes verticais, sendo que alguns diagnósticos só podem ser realizados quando o tecido é visualizado em cortes horizontais. Há diferentes formas de avaliar alopecia e, mesmo na literatura, não existe consenso, apenas recomendações. Alguns autores realizam dois punchs nos casos de alopecia cicatricial, um primeiro para corte horizontal e um segundo para corte vertical1, enquanto outros autores enfatizam que, se apenas uma amostra for obtida, essa deveria ser encaminhada para corte horizontal2. A necessidade de se solicitar punch adicional para corte vertical também depende da experiência e da familiaridade com os cortes horizontais que o patologista tem, sendo que a comunicação do dermatologista com o patologista quando for realizar a biópsia deve ser praticada para estarem alinhados quanto à quantidade de amostras e quanto ao tipo de corte que o patologista utiliza. Todavia, com a crescente experiência do patologista em analisar cortes horizontais, a necessidade desse segundo punch para corte vertical acaba desaparecendo3.
Raramente duas ou mais amostras são necessárias quando houver suspeita de dois ou mais tipos de alopecia. Por exemplo, uma área com alopecia androgenética e outra com líquen plano pilar, sendo que cada uma está em locais distintos do couro cabeludo.
2.3 Tamanho do espécime e amostra insatisfatória
A amostra deve ser feita por punch 4, com cerca de 6mm de espessura, que inclua o tecido subcutâneo4, pois os parâmetros das contagens foliculares foram desenvolvidos em punchs com essas dimensões.
A presença do tecido subcutâneo na amostra é muito importante não só devido ao fato de os bulbos estarem no tecido subcutâneo, mas também porque a presença de hipoderme na amostra garante a estabilidade do espécime no bloco de parafina durante a inclusão, evitando o tangenciamento do corte histológico.
Nos espécimes que amostram apenas até a derme média não se consegue a visualização horizontal do istmo folicular, sendo, portanto, considerados insatisfatórios para avaliação de alopecias não-cicatriciais. Recomenda-se relatar no laudo o motivo da impossibilidade de se realizar a contagem folicular (p.ex.: ausência de visualização do nível ístmico).
2.4 Fixação
A amostra obtida para o exame histopatológico deve ser, imediatamente após a sua retirada, submersa em recipiente transparente e de boca larga, contendo formalina tamponada (formol tamponado a 10%) em volume cerca de 20x o tamanho da amostra.
2.5 Requisição de exame histopatológico
Além dos dados pessoais e epidemiológicos do paciente, é importante que a requisição contenha a descrição sumária do quadro clínico, sua evolução, resultados de exames complementares e hipóteses diagnósticas, pois fazem parte dos pré-requisitos para um laudo completo e contextualizado. Designação de qual região do couro cabeludo a amostra foi retirada deve também estar informada (p.ex.: região parietal, coroa, vértice, occipital, frontal ou temporal).
3. Avaliação laboratorial pré-analítica
3.1 Macroscopia
Nos casos de alopecia, como a amostra é preferencialmente realizada por punch (cilindro), a macroscopia deve ser direcionada ao corte especial para alopecia (corte histológico horizontal/transversal). Apenas com essa disposição horizontal dos folículos se consegue realizar as contagens foliculares, que é essencial no diagnóstico principalmente das alopecias não-cicatriciais (Fig. 3).
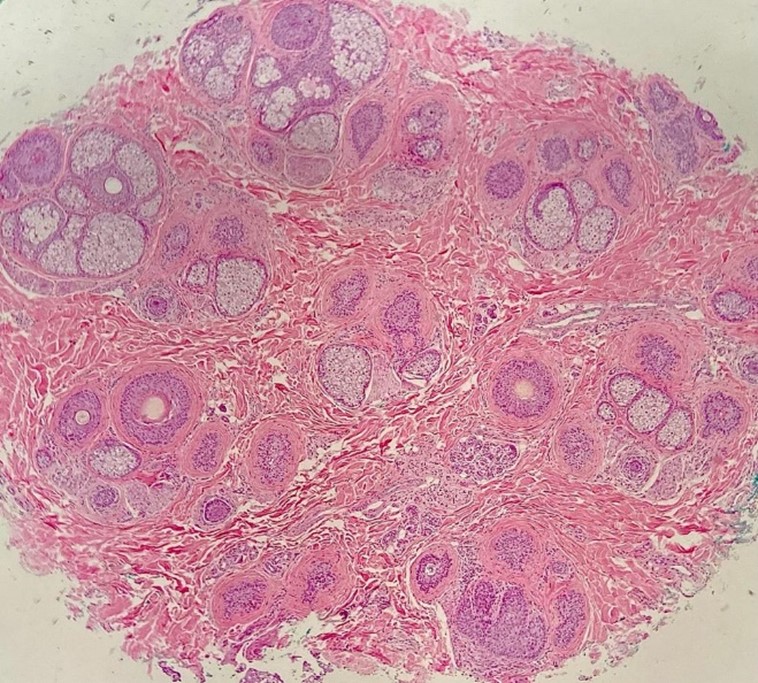
Fig. 3. Visualização da totalidade dos folículos na amostra através de cortes horizontais.
O corte macroscópico deve ser feito a 01mm da junção dermoepidérmica, pintando-se com tinta nanquim as faces bissectadas para posterior inclusão no molde de parafina com as faces pintadas para baixo, de acordo com o protocolo de Headington (Fig. 4 e 5).

Fig. 4. Esquema de corte horizontal descrito por Headington: consiste em seccionar o punch em duas porções no nível do istmo.

Fig. 5. Punch 4 com corte macroscópico a 01mm da junção dermoepidérmica. Faces bissectadas pintadas com tinta nanquim.
Alguns autores preferem o corte macroscópico em HoVert, uma associação de corte vertical, para amostrar a epiderme de forma vertical, com os demais cortes horizontais a partir do istmo, para possibilitar a contagem folicular (Fig. 6).
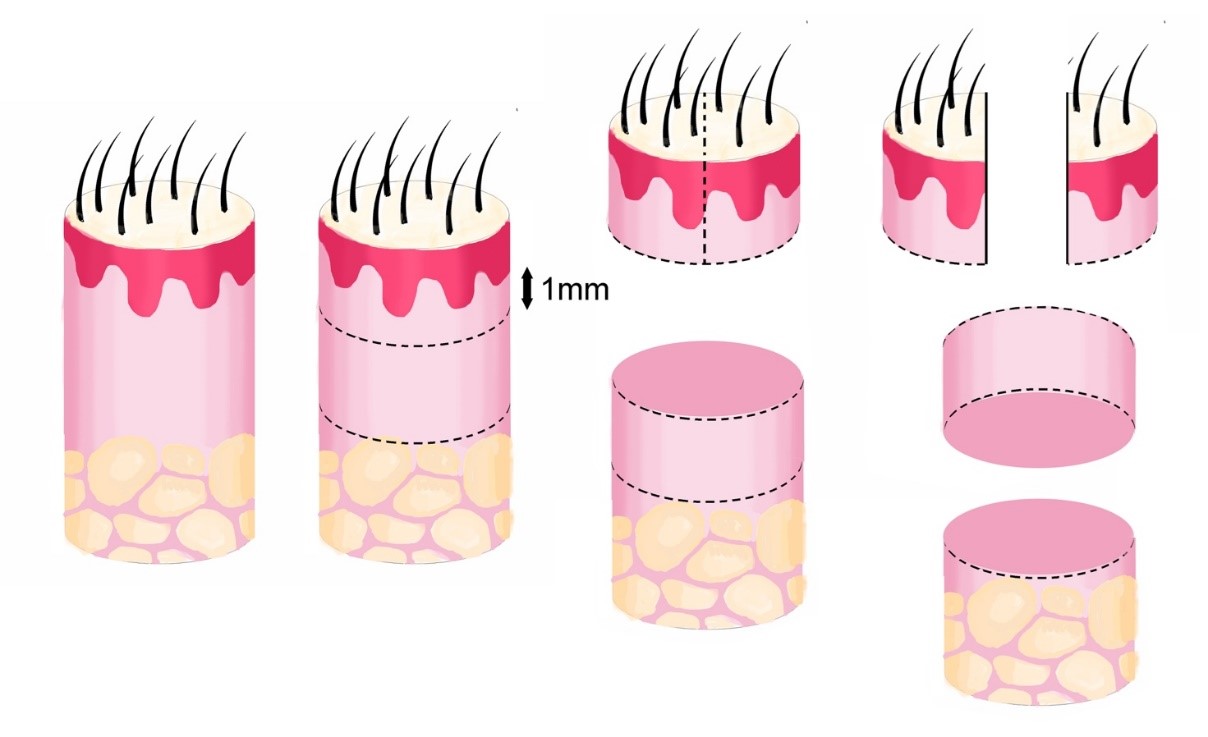
Fig. 6. Técnica HoVert: contempla cortes verticais (para visualizar a epiderme) com cortes horizontais (para visualizar os folículos).
3.2 Inclusão
A inclusão dos cortes horizontais deve ser realizada com as faces pintadas de nanquim para baixo com a finalidade de ter-se o corte do istmo como um dos primeiros, sendo esse o nível mais importante para a contagem do diâmetro dos folículos (Fig. 7). Em caso de preferência pelos cortes verticais, a inclusão segue conforme a rotina do serviço.

Fig. 7. Após seccionado, o punch será incluído na parafina com as faces pintadas para baixo.
3.3 Microtomia
De acordo com o protocolo de Headington, os cortes horizontais podem ser realizados de forma seriada com espessura de 04μm, iniciando-se no istmo. Em seguida, aprofunda-se no bloco de 15 a 20 desbastes, e mais uma amostragem. Posteriormente, mais 15 a 20 desbastes, e mais uma amostragem, até se chegar à epiderme na parte superior do punch, e simultaneamente ao tecido subcutâneo na parte inferior do punch (Fig. 8, 9 e 10).
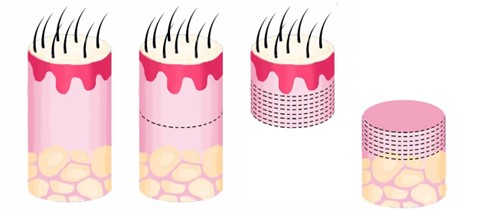
Fig. 8. Punch 4 (à esquerda), corte macroscópico no punch (segunda imagem à esquerda) e após cortes no micrótomo (as duas imagens à direita).

Fig.9. Ao incluir na parafina, cuidar para aproximar as duas partes do punch para otimizar o espaço da lâmina.
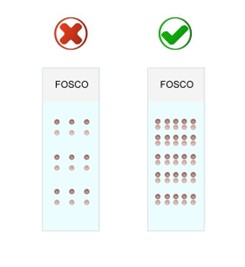
Fig. 10. Para melhor aproveitamento da lâmina, do tempo e do arquivo de lâminas, sugere-se o layout mostrado à direita. De um lado do fragmento iremos enxergando cada vez mais superiormente (cilindro mais escuro) e do outro cada vez mais inferiormente (área mais clara do fragmento).
No caso de cortes HoVert, pode-se colocar cada fragmento vertical e horizontal em cassetes separados, para se realizar o corte vertical em um bloco e o corte seriado horizontal no outro bloco.
| Vantagens e desvantagens dos diferentes cortes utilizados para a avaliação microscópica da alopecia:
▪ Headington (corte horizontal). É o mais utilizado para avaliação de alopecia e o único que permite a visualização da disposição dos istmos de todos os folículos da amostra, possibilitando a quantificação e a discriminação deles em terminais, miniaturizados, anágenos e telógenos. É considerado superior ao corte vertical, principalmente em alopecias não-cicatriciais5. A desvantagem é que a epiderme só pode ser visualizada de forma tangenciada na borda do punch, devendo ser evitado em suspeitas de lesões melanocíticas ou outras inflamatórias que não causem alopecia. Apesar disso, nos casos de lúpus eritematoso do couro cabeludo, consegue-se identificar o espessamento da membrana basal e o dano vacuolar da epiderme por meio do desbaste realizado nos cortes horizontais de alopecia. Outra desvantagem é a falta de familiaridade do patologista com as estruturas da pele em corte transversal bem como dos técnicos em patologia que podem acabar “desbastando” o nível do istmo caso não procederem a técnica minuciosamente, porém, com o corriqueiro uso dessa técnica, essas dificuldades tendem a desaparecer. ▪ HoVert. A vantagem seria a visualização vertical tanto da epiderme como se está habituado, assim como dos folículos de forma horizontal através do corte na altura do istmo para quantificação folicular. A desvantagem seria que é possível perder a visualização da porção mais superior do istmo, próxima do infundíbulo, de todos os folículos, sendo muitas vezes imprescindível para o diagnóstico das alopecias que acometem predominantemente essa região, como a FAPD. ▪ Corte vertical. A grande vantagem do corte vertical é a familiaridade tanto dos técnicos como dos patologistas com a disposição em camadas epiderme / derme / hipoderme, sendo a epiderme perfeitamente visualizada, sem tangenciamento. Contudo, o corte vertical na avaliação das alopecias não-cicatriciais é de utilidade muito limitada, pois não permite examinar todos os folículos. O corte vertical também impede a quantificação total dos folículos, bem como a avaliação das proporções entre anágenos e telógenos, e entre terminais e miniaturizados2,4, que ficam distorcidos, impossibilitando o diagnóstico diferencial entre os tipos de alopecia não-cicatricial. |
3.4 Colorações de rotina
- Hematoxilina e eosina
- Ácido periódico de Schiff (PAS) deve ser utilizado em casos com suspeita clínica ou microscópica de tinea capitis
- Colorações para colágeno (p.ex.: tricromo de Masson e picro-sírius) podem ser feitas para evidenciar as fibras colágenas e assim auxiliar na diferenciação entre a fibrose da alopecia androgenética e a fibrose do líquen plano pilar, sendo que no líquen plano pilar a coloração destaca o colágeno separado do folículo pela área de fibrose em “casca de cebola” (que não se cora pelo tricromo de Masson nem pelo picro-sírius), e na alopecia androgenética a coloração é positiva já na zona que circunda o folículo, pois o colágeno não foi perdido4. Contudo, é importante ressaltar que as colorações especiais em alopecia requerem que se apareça na lâmina da coloração especial exatamente o folículo que estamos estudando e nem sempre isso é possível na prática.
Referências
- Tailor A, Asher RG, Craig PJ, et al. The current state of play in the histopathologic assessment of alopecia: two for one or one for two? J Cutan Pathol. 2013 Mar;40(3):298‒304.
- Miteva M (ed). Alopecia. St. Louis: Elsevier; 2019.
- Sperling L. The role of scalp biopsy in the evaluation of alopecia. J Am Acad Dermatol. 2023;89(2S):S16-S19.
- Miteva M (ed). Hair Pathology with Trichoscopic Correlations. Boca Raton: CRC Press; 2022.
- Yadav D, Mahajan S, Agarwal S, et al. Vertical versus transverse sections in histopathological diagnosis of alopecia: a comparative study, Indian J Dermatol Venereol Leprol. 2023;89(1):126‒129.
