Autora
Annelise de Almeida Verdolin
Departamento de Patologia, Rede D’Or/São Luiz Hospital, Rio de Janeiro (RJ), Brasil
1. Realizando a biópsia
1.1 Tipos de biópsia
- Biópsia incisional. Amostra parcial da lesão (p.ex.: punch, shave, etc.).
- Biópsia excisional. Amostra total da lesão (p.ex.: fuso, ressecção ampla, etc.). Após confirmação do diagnóstico, o tratamento é cirúrgico e pode ser feito com uma ressecção ampla e profunda até a fáscia. É recomendável 10-20mm de margem livre.
- Ampliação de margens / re-excisão. Fuso, ressecção ampla, etc.
- Punção aspirativa por agulha fina e core biopsy. Ambos são opcionais para linfonodos clinicamente positivos, sendo necessário confirmação por imunocitoquímica e/ou imuno-histoquímica.
- Linfadenectomia e linfonodo sentinela. É realizado no mesmo tempo cirúrgico da excisão da lesão, sendo um fator prognóstico importante.
- Linfadenectomia e linfonodos regionais (vide adiante).
- Exame intraoperatório de congelação. Não há indicação de congelação para diagnóstico deste tipo de lesão ou para avaliação de comprometimento linfonodal. Ambos devem ser avaliados em material parafinado e confirmados em exame imuno-histoquímico.
- Cirurgia de Mohs. É uma boa opção em lesões de face, por exemplo, ou nos casos em que não se pode ressecar com margem de pelo menos 10mm, visando preservar maior superfície da pele da região para reconstrução ou preservação de nervos da região. A ressecção ampla e a cirurgia micrográfica de Mohs são igualmente aceitas, com resultados similares em taxas de recorrência e sobrevida.
1.2 Fixação
A amostra obtida para o exame histopatológico deve ser, imediatamente após a sua retirada, submersa em recipiente transparente e de boca larga, contendo formalina tamponada (formol tamponado a 10%) em volume cerca de 20x o tamanho da amostra.
1.3 Requisição de exame histopatológico
Além dos dados pessoais e epidemiológicos do paciente, é importante que a requisição contenha a descrição sumária do quadro clínico, sua evolução, resultados de exames complementares e hipóteses diagnósticas, pois fazem parte dos pré-requisitos para um laudo completo e contextualizado[1].
- Idade e imunodepressão. O carcinoma de células de Merkel ocorre mais frequentemente em pacientes brancos, idosos, imunodeprimidos (p.ex.: transplantados, HIV+, leucemia linfocítica crônica) e tem associação com infecção por poliomavírus.
- Topografia da lesão e características clínicas. Tipicamente se apresenta como um nódulo de crescimento rápido, avermelhado ou violáceo, assintomático, que surge em áreas fotoexpostas, principalmente na cabeça e pescoço, seguido pelas extremidades e tronco.
- História de neoplasia prévia e atual. Pode se associar a uma segunda malignidade, sendo a leucemia linfocítica crônica a mais comum e o carcinoma de células escamosas o segundo mais comum.
- Tamanho no maior eixo da lesão clínica. O estadiamento do carcinoma de células de Merkel é feito pela maior medida da lesão clínica antes da realização da biópsia. Na ausência desta, poderá ser considerada a medida feita na macroscopia. A forma realizada para medição e utilizada para estadiamento deve ser referida no laudo.
- Evidência clínica ou de imagem de envolvimento linfonodal. A evidência de envolvimento linfonodal oculto ou detectado clinicamente é essencial para a realização do estadiamento pN.
2. Avaliação laboratorial pré-analítica
2.1 Macroscopia e amostragem para microscopia
2.1.1 Peça principal
- Tipo da amostra. Cone, fuso, fragmento irregular, retalho, etc.
- Medição. Tamanho nas suas três dimensões.
- Tumor macroscópico presente. Referir a maior dimensão, que será usada no estadiamento pT, e as dimensões adicionais. Indicar também a distância da lesão em relação às margens circunferenciais e à margem profunda mais próximas, assim como a presença de extensão extracutânea (p.ex.: fáscia, cartilagem, músculo e osso). Em espécimes excisionais, quando enviado com marcação para posicionamento anatômico, diferentes cores deverão ser usadas para identificar as respectivas margens (Fig. 1a e 1b). A biópsia excisional deve ser seccionada em “fatia de pão” a cada 02-04mm, em cortes perpendiculares ao seu menor eixo (Fig. 1c).
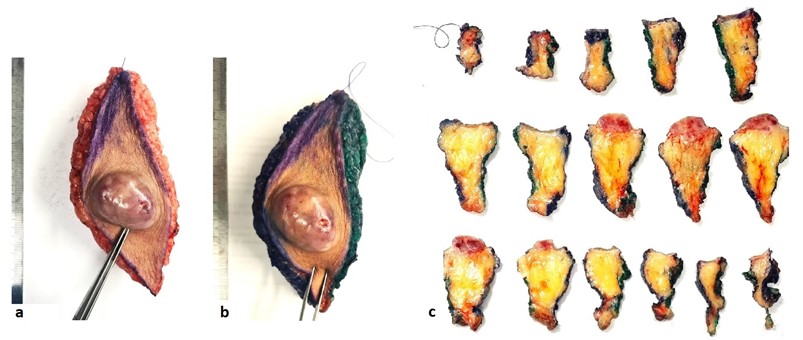
Fig. 1. (a) Fuso de pele enviado com marcação por fio às 12h. (b) Margem das 12h às 06h tingida de verde e das 18h às 24h, de azul. (c) Cortes sequenciais, a cada 02-04mm, perpendiculares à lesão, foram realizados no sentido das 12h às 06h, mantendo a orientação para o posicionamento anatômico. O fragmento no canto superior esquerdo corresponde à marcação por fio às 12h e o fragmento no canto inferior direito corresponde à última fatia referente às 6h. Ambos devem ser identificados em cassetes separados e referidos na clivagem para orientação pós-macroscopia.
Quanto maior a amostragem, maior a acurácia da avaliação. Mapeamento das margens com as respectivas diferentes cores de tinta usadas podem contribuir para uma melhor visualização e identificação (Fig. 2a e 2b). Recomenda-se evitar inserir mais de dois fragmentos de pele por cassete (Fig. 2c).
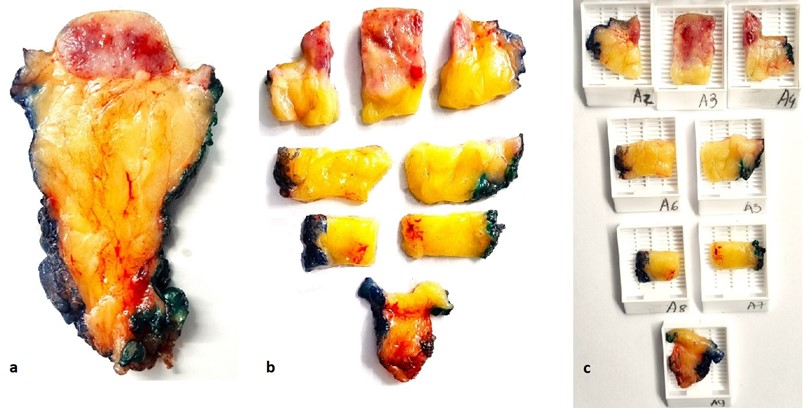
Fig. 2. (a) Selecionada uma fatia após cortes sequenciais do espécime excisional. (b-c) Demonstração de como realizar o mapeamento macroscópico. Outras fatias com lesão e relação com margens deverão ser selecionadas para maior representatividade da amostra. Nesse caso, a lesão é bem delimitada e a representação da amostra pode ser parcial, incluindo as áreas de maior espessura lesional e maior proximidade com as margens.
- Tumor não visível. A identificação macroscópica do tumor pode não ser possível nos casos de biópsia incisional, ampliação de margens, re-excisão, amostra fragmentada, etc. Nessas situações, está indicada a inclusão total da amostra para avaliação histopatológica. Nos casos de ampliação de margem ou re-excisão, a inclusão total visa a garantir a avaliação de possível neoplasia residual ou satélite. Outras indicações de inclusão total são limite da lesão indefinido após cortes consecutivos e/ou amostras menores que 10mm. Em caso de re-excisão, é também importante relatar se a cicatriz foi completamente removida.
- Amostragem parcial. Peças a partir de 10mm, com lesão bem delimitada e visível, podem ser amostradas parcialmente, considerando as margens mais próximas, representatividade da lesão, espessura máxima do tumor e características incomuns.
2.1.2 Linfonodos
- Descrição. Tamanho da amostra nas suas três dimensões, número de linfonodos dissecados, e a medida do maior e do menor linfonodos isolados.
- Secção. Os linfonodos devem ser seccionados sucessivamente em “fatia de pão” a cada 02-04mm no seu menor eixo e submetidos em sua totalidade quando macroscopicamente negativos.
- Cada linfonodo deve seguir em cassete próprio e devidamente identificado no mapeamento de clivagem. Os linfonodos macroscopicamente positivos podem ser representados parcialmente (Fig. 3).
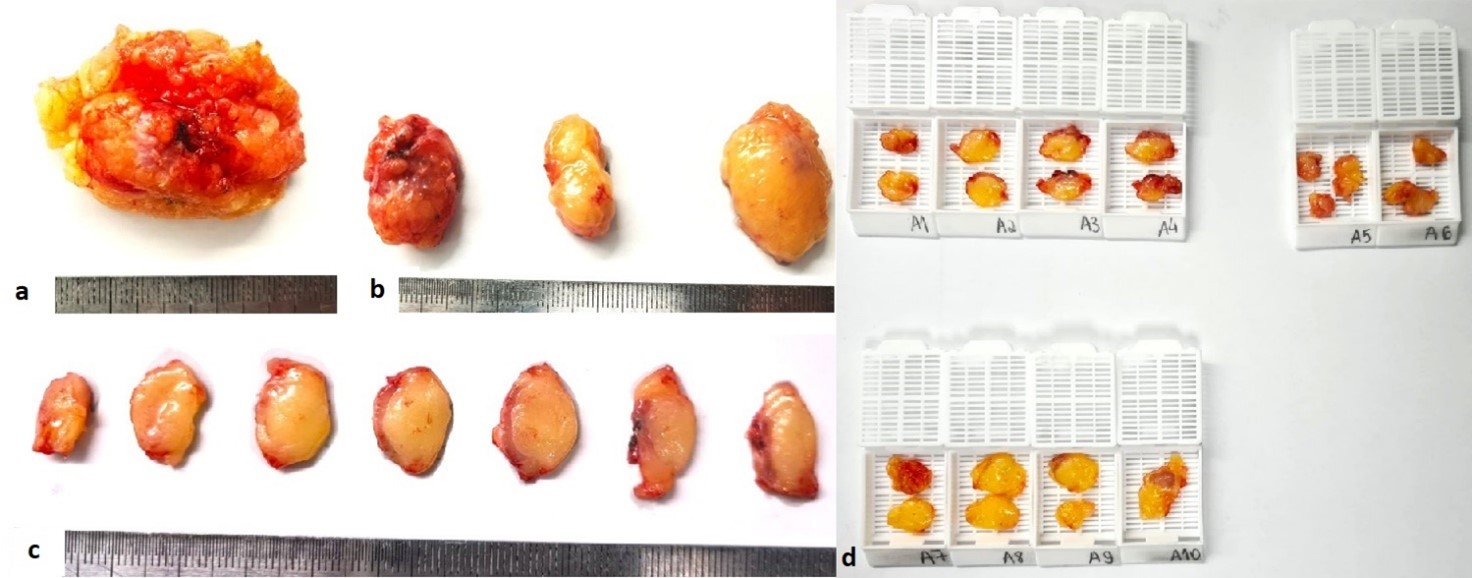
Fig. 3. (a) Linfadenectomia, linfonodos sentinelas, amostra total enviada. (b) A amostra foi dissecada e foram identificados três linfonodos. (c) Exemplificação de cortes sequenciais em “fatia de pão” a cada 02-04mm, evidenciando linfonodo macroscopicamente negativo. (d) Os linfonodos foram totalmente submetidos para análise histológica devido a ausência de metástase macroscópica. Clivagem do A1 ao A4 corresponde ao primeiro linfonodo, do A5 ao A6 ao segundo linfonodo, e do A7 ao A10, ao terceiro linfonodo.
2.2 Colorações e exame imuno-histoquímico
O exame microscópico exige lâminas coradas pelo HE e realização de estudo imuno-histoquímico. Este último deve incluir CK20 (preferencialmente, devido à sensibilidade de 90%) e pelo menos um marcador neuroendócrino (p.ex.: cromogranina, sinaptofisina, NSE, neurofilamento e CD56) para confirmação diagnóstica. TTF-1, CD45, S100 e melan A também são importantes para afastar, respectivamente, metástase cutânea do carcinoma de pequenas células do pulmão, linfoma e melanoma. O padrão de imunopositividade pode variar entre anticorpos, sendo bem reconhecidos o padrão perinuclear tipo “dot” ou tipo “cap”, marcação de membrana ou de grânulos citoplasmáticos.
3. Avaliação microscópica
- Subtipos histológicos. Intermediário (mostra padrão de crescimento em lençol, difuso com células grandes), pequenas células (células descoesas, pequenas e redondas), trabecular (forma colunas com 2 a 3 células de espessura e pode apresentar células fusiformes) e combinado (contém dois ou mais dos subtipos anteriores). Esta subcaterigorização está obsoleta, porém é importante saber e reconhecer os subtipos histológicos até porque, na presença de células grandes, pleomórficas ou claras, é provável que o poliomavírus esteja ausente. Na forma combinada, pode ter elementos carcinomatosos (principalmente diferenciação escamosa) e/ou sarcomatosos.
- Tipo de procedimento cirúrgico
- Sítio da biópsia e lateralidade
- Tamanho do tumor. Em biópsia incisional, referir a medida em mm, ainda que parcial (“pelo menos __mm”) ou indicar se é indeterminado (p.ex.: caso de ampliação de margem, amostra fragmentada).
- Índice mitótico. Número de mitoses/mm².
- Nível de invasão. Derme, tecido subcutâneo, fáscia, cartilagem, músculo esquelético, osso, etc. Recomenda-se relatar as estruturas livres presentes (p.ex.: cartilagem livre de neoplasia).
- Espessura tumoral. Igual à espessura de Breslow, medida do estrato granuloso até a profundidade da lesão.
- Invasão linfovascular. Presente, não detectada ou indeterminada.
- Infiltração linfocítica tumoral. Avaliação da relação do infiltrado de linfócitos com a base e o estroma tumoral, sendo considerado ativo se circundar totalmente a base do tumor e/ou se permear completamente o tumor. Caso contrário, é considerada presente e inativa, ou ausente se não houver infiltrado.
- Padrão de crescimento. Nodular (referido quando o tumor é bem circunscrito em relação ao estroma circundante) ou infiltrativo (referido quando houver áreas infiltrativas irregulares e falta de circunscrição). Quando presente ambos os padrões, classificar como infiltrativo.
- Neoplasia maligna secundária. Se presente, especificar.
- Margens cirúrgicas. Se livre de neoplasia, relatar a distância em relação aos limites circunferencial e profundo mais próximos (opcional: <01mm, entre 01-05mm, >05mm). Se comprometida, especificar qual(is), se possível.
- Linfonodos regionais. Informar o número de linfonodos avaliados (inclusive o número de sentinelas e não-sentinelas), o número de linfonodos livres e o número de linfonodos comprometidos, referindo também o tamanho do maior foco metastático e se há ou não extensão extranodal. O linfonodo negativo na coloração pela hematoxilina-eosina deve ser submetido a cortes histológicos seriados em 2 lâminas e ao estudo imuno-histoquímico para confirmação. Deve-se incluir ao menos um anticorpo que tenha imunopositividade no tumor primário (CK20, preferencialmente, ou AE1/AE3, Cam 5.2, CD56, NSE, sinaptofisina e/ou cromogranina). Células tumorais isoladas em um linfonodo são classificadas como micrometástase e o respectivo estadiamento identificado como pN1a. O linfonodo sentinela positivo indica o esvaziamento linfonodal e a radioterapia adjuvante é recomendada em quase todos os casos. Não há indicação de estudo molecular ou exame imuno-histoquímico para pesquisa de poliomavírus em linfonodo e para pesquisa de micrometástase, exceto nas situações em que o tumor primário demonstrou positividade. Depósitos tumorais ou linfonodos acometidos próximos a alguma margem cirúrgica devem ser referidos com a distância para a margem mais próxima.
- Metástase em trânsito. Definida como lesão distinta da neoplasia primária, localizada distalmente à lesão primária ou entre esta e a respectiva cadeia linfonodal. Como a presença de múltiplas lesões simultâneas de carcinoma de células de Merkel é extremamente raro, estas são mais bem interpretadas como metástases em trânsito. Em caso de metástase em trânsito ou à distância, indicar o sítio.
Para os critérios de elaboração de laudo microscópico estruturado, consultar o Manual de Padronização de Laudos Histopatológicos da Sociedade Brasileira de Patologia:
https://www.sbp.org.br/manual-de-laudos-histopatologicos/pele-carcinoma-celulas-merkel/
4. Estudos moleculares**
- Subtipo com alta carga mutacional tumoral (CMT). Está associado a mutações relacionadas com exposição a radiação ultravioleta e a mutações nos genes TP53 e RB1, além da ausência do genoma do poliomavírus. Em consequência, esse subtipo molecular apresenta imunopositividade para p53 e p63 e imunonegatividade para Rb (a proteína do retinoblastoma é perdida nos casos negativos para poliomavírus).
- Subtipo com baixa CMT. Apresenta o perfil molecular oposto (ausência das mutações genéticas), a presença do DNA do poliomavírus, imunoexpressão do Rb e negatividade para p53 e p63.
5. Prognóstico
Se correlacionam com pior prognóstico: espessura tumoral, nível de invasão (a partir do subcutâneo), invasão angiolinfática, >10 mitoses / campo de grande aumento (atualmente utilizado a contagem em 01mm² para maior padronização e reprodutibilidade interobservadores), Ki67 >50%, presença de infiltração linfocítica (controverso), padrão de crescimento infiltrativo (sugerido em dados preliminares), subtipo com alta CMT, ausência de associação com poliomavírus.
O estadiamento atualmente proposto pela AJCC é amplamente baseado na casuística e experiência isolada de grandes centros de tratamento oncológico e, apesar do estadiamento vigente ser considerado o melhor preditor de sobrevida, não há consenso até o momento sobre qual a melhor metodologia a ser empregada para estadiar. Por exemplo, atualmente o estadiamento é baseado no tamanho tumoral, porém há uma crescente evidência de que a espessura tumoral tem melhor correlação com recorrência local, metástase linfonodal e pior sobrevida quando comparado com o tamanho tumoral.
Referências
- Abbasi AN, Ahmed SM, Qureshi BM. Recent updates in the management of Merkel cell carcinoma. J Pak Med Assoc. 2019;69(11):1693‒1699.
- Amin MB, Edge SB, Greene FL, et al (eds). AJCC Cancer Staging Manual. 8th ed. New York: Springer; 2017.
- Duprat JP, Landman G, Salvajoli JV, et al. A review of the epidemiology and treatment of Merkel cell carcinoma. Clinics (Sao Paulo). 2011;66(10):1817‒1823.
- Elder DE, Massi D, Scolyer RA, et al (eds). WHO Classification of Skin Tumours. 4th ed. Lyon: IARC Press; 2018.
- Lebbe C, Becker JC, Grob JJ, et al. Diagnosis and treatment of Merkel cell carcinoma. European consensus-based interdisciplinary guideline, Eur J Cancer. 2015;51(16):2396‒2403.
- Rastrelli M, Del Fiore P, Russo I, et al. Merkel cell carcinoma: evaluation of the clinico-pathological characteristics, treatment strategies and prognostic factors in a monocentric retrospective series (n=143). Front Oncol. 2021;11:737842.
- Rastrelli M, Ferrazzi B, Cavallin F, et al. Prognostic factors in Merkel cell carcinoma: a retrospective single-center study in 90 patients. Cancers (Basel). 2018;10(10):350.
- Schmults CD, MD, Blitzblau R, Aasi SZ, et al. NCCN Clinical practice guidelines in oncology (NCCN Guidelines). Merkel cell carcinoma. NCCN Eeidence blocks. Version 2.2022. Available online: https://merkelcell.org/wp-content/uploads/2022/03/mcc_blocks.pdf (accessed on 18 October 2023).
- Slater D, Ali R. Standards and datasets for reporting cancers. Dataset for histopathological reporting of primary cutaneous Merkel cell carcinoma and regional lymph nodes. London: The Royal College of Pathologists; 2019.
- Walsh NM, Cerroni L. Merkel cell carcinoma: a review. J Cutan Pathol. 2021;48(3):411‒421.
- Wang TS, Byrne PJ, Jacobs LK, et al. Merkel cell carcinoma: update and review. Semin Cutan Med Surg. 2011;30(1):48‒56.
[1]O acrônimo em inglês AEIOU auxilia na identificação das informações clínicas pertinentes da seguinte forma: A = assintomático; E = Expansão rápida; I = imunossupressão; O = older (acima de 50 anos); U= exposição a radiação ultravioleta.
**Atualmente, o uso de métodos moleculares como PCR para evidenciar DNA do poliomavírus do carcinoma de células de Merkel no tecido tumoral para fins diagnósticos não é recomendado, dada a presença de DNA deste vírus em outras neoplasias cutâneas, extracutâneas e em tecidos normais, sendo, portanto, achado inespecífico. Entretanto, possuem valor prognóstico, já que o subtipo molecular com alta CMT/ausência do DNA do poliomavírus está relacionado a um pior prognóstico, ao passo que, o de baixa CMT /presença do DNA do poliomavírus está associado a um melhor prognóstico.
