Autores
Raimundo Gerônimo da Silva Júnior, Laura Carolina López Claro, Aloísio Souza Felipe da Silva, Cleto Dantas Nogueira, Emilio Augusto Campos Pereira de Assis, Evandro Sobroza de Mello, Igor Campos da Silva.
A avaliação das biópsias gástricas têm extrema importância na detecção de doenças inflamatórias gástricas, lesões adaptativas, condições pré-neoplásicas e lesões malignas.
Amostragem Endoscópica e Informes Clínicos
O número de fragmentos ideal depende do objetivo clínico da biópsia, em média são necessários de 4 a 6 fragmentos, incluindo amostras do corpo e antro, para pesquisa de H. Pylori e estadiamento das gastrites. As amostras devem ser prontamente fixadas em formol tamponado a 10% e acondicionadas em frascos separados devidamente identificados.
A informação clínica, achados endoscópicos e topografia das amostras é extremamente relevante na interpretação dos achados histopatológicos.
Ao receber a amostra é necessário avaliar todos os componentes da mucosa e interpretar todas as alterações presentes nos compartimentos avaliados. A amostra ideal deve ser representada por lâmina própria, epitélio superficial e glandular e muscular da mucosa.
1. GASTRITES
1.1. Gastrite crônica:
Definição: é a inflamação persistente da mucosa gástrica, por um período determinado e que pode levar a alterações crônicas como atrofia, metaplasia intestinal e displasia.
Etiologia: frequentemente está associada à infecção pelo Helicobacter pylori, porém outras causas como autoimunidade, uso de substâncias tóxicas (álcool e medicamentos), refluxo biliar, irradiação e doenças granulomatosas entre outras, podem estar presentes.
Quadro histológico geral: embora os subtipos específicos tenham aspectos histológicos característicos, em termos gerais a gastrite crônica é representada por infiltrado linfoplasmocitário, expandindo a lâmina própria, por vezes com formação de agregados linfoides. Neutrófilos e eosinófilos também estão presentes. A infiltração neutrofílica em epitélio e lúmen glandular caracterizam a gastrite crônica em atividade. As alterações epiteliais incluem hiperplasia foveolar reparativa.
| CONCEITOS CHAVE |
|---|
| – Inflamação crônica: infiltrado predominantemente plasmocitário focal com ou sem destruição glandular visto no mínimo com aumento 10x;
– Gastrite crônica inativa: denso infiltrado na lâmina própria linfoplasmacítico com destruição glandular visto no aumento de 4x; – Gastrite crônica ativa: agressão neutrofílica glandular em adição ao infiltrado linfoplasmocitário. |
Tabela 1
Subtipos específicos de gastrite crônica:
1.1.1. Gastrite por Helicobacter pylori: caracterizada por infiltrado inflamatório misto, rico em plasmócitos, atividade neutrofílica, agregados/folículos linfoides com centros germinativos e, o imprescindível, a presença de bacilos curvos, espiralados presentes na superfície epitelial e na luz glandular. Colorações específicas não são consideradas essenciais, principalmente naquelas biópsias normais, no entanto, naquelas biópsias com quadro histológico característico que não evidenciam o bacilo na coloração de H&E, será necessária a realização de métodos histoquímicos (Giemsa modificado ou Warthin-Starry) ou imunohistoquímicos para a pesquisa do bacilo – tabela 2. Neste cenário, a Doença de Crohn pode ser um diagnóstico diferencial.
Indicação de realização de reação imuno-histoquímica para detecção do H. pylori (na ausência do organismo pelo H&E e/ou nas colorações específicas):
|
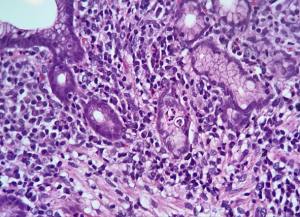
H&E. Gastrite crônica, em atividade. Lâmina própria com infiltrado linfoplasmocitário e presença de neutrófilos agredindo o epitélio glandular.
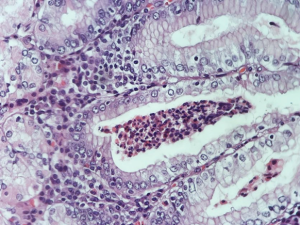
H&E. Gastrite Crônica em atividade. A lâmina própria apresenta infiltrado linfo-plasmocitário com presença de abscessos foveolares neutrófilos. Observa-se também alterações reativas do epitélio, apresentando clarificação do citoplasma, com discretas atipias nuclares, sem mitosis atípicas pu pleomorfismo.
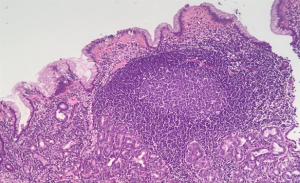
H&E. Presença de folículos linfoides com centro germinativo evidente.
A
B
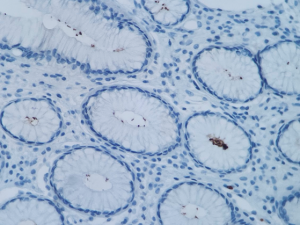
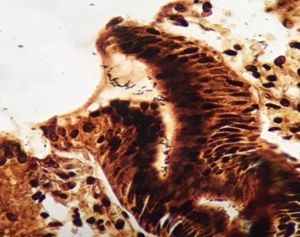
C. Infecção por Helicobacter Pylori. A- Coloração de Giemsa. B- Coloração de Warthin-Starry. Presença de bacilos tingidos em preto, em lúmen da superfície luminal. C- Imunohistoquímica para Helicobacter Pylori evidenciando formas bacilares no lúmen glandular.
1.1.2. Gastrite atrófica: definida como perda de glândulas gástricas adequadas. A gastrite atrófica ambiental é mais frequente na mucosa antral e multifocal. Se inicia na mucosa da incisura e posteriormente afeta o antro, poupando o corpo. A gastrite atrófica corpórea é associada a gastrite autoimune.
Histologicamente existem dois padrões de atrofia: metaplásico e não metaplásico. O padrão não metaplásico se caracteriza pela depleção de glândulas com substituição por tecido conjuntivo. O padrão metaplásico se subdivide em intestinal e pseudopilórico. O intestinal é caracterizado pela presença de metaplasia intestinal corpórea (células caliciformes ou células de Paneth) e pode ocorrer em mucosa antral e corpo-fúndica. O subtipo pseudopilórico é a substituição de glândulas corpo-fúndicas por glândulas de padrão antral, portanto este tipo só acontece na mucosa corpo-fúndica.
1.1.3 Gastrite autoimune: caracterizada pelo intenso infiltrado linfoplasmocitário com destruição de células parietais, por linfócitos T CD4+, com consequente perda de glândulas metaplasia intestinal, pseudopilórica e acinar pancreática em corpo e fundo. A mucosa antral apresenta padrão reativo (químico) e é poupada de atrofia. A hipocloridria secundária leva ao aumento das células G, produtoras de gastrina, no antro e hiperplasia de células neuroendócrinas no fundo.
Em casos com extensa metaplasia pseudopilórica, a confirmação do sítio corpóreo pode ser feita por técnica imuno-histoquímica com pesquisa de gastrina (negativa na mucosa tipo corpo-fundo). Para avaliação de proliferações neuroendócrinas hiperplásicas e displásicas deve-se utilizar marcadores neuroendócrinos.
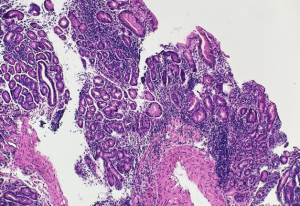
H&E. Gastrite autoimune. Exemplos de mucosa gástrica referida como corpórea, com perda de glândulas oxínticas e substituição por glândulas metaplásicas de padrão intestinal.
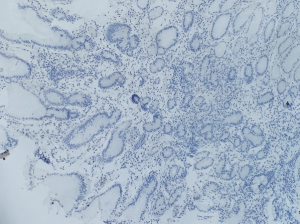
Imunohistoquímica de gastrina. Exame complementar necessário em amostras referidas como corpo-fúndicas, com caracteristicas de mucosa antral. A negatividade da gastrina indica não se tratar de mucosa antral e sim de mucosa corpórea com metaplasia pseudopilórica.
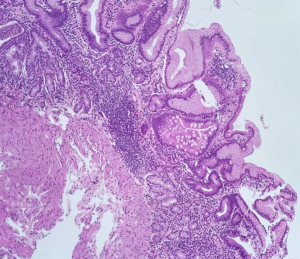
H&E. Amostra orientada de forma adequada, referida como de mucosa corpórea com depleção de glândulas oxínticas e substituição por mucosa antral e intestinal.
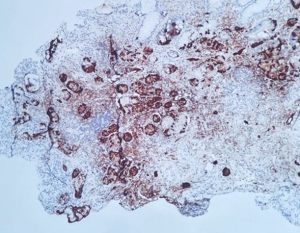
Imunohistoquímica de cromogranina, evidenciando a proliferação de células neuroendócrinas, fazendo revestimento completo ou parcial das glândulas (padrão linear), assim como em pequenos grupamentos (padrão micronodular).
1.1.4. Gastrite química: comumente encontrada no uso de substâncias tóxicas, álcool, anti-inflamatórios não esteroides e refluxo gastroduodenal. O infiltrado inflamatório costuma ser linfocitário e discreto, sem sinais de agressão epitelial. O achado histológico característico é a hiperplasia foveolar em saca-rolhas, com fovéolas tortuosas, irregulares e longas, com atipias nucleares discretas, perda da eosinofilia por depleção de mucina.
Em uma biópsia gástrica antral que, no menor aumento, tem escasso componente inflamatório, esta possibilidade diagnóstica deve ser considerada.
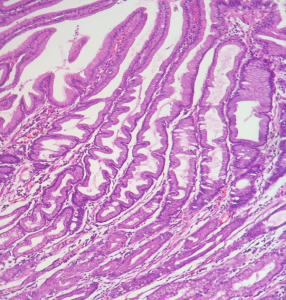
Mucosa gástrica com mínimo infiltrado inflamatório em lâmina própria, congestão vascular e alterações epiteliais reparativas com aspecto tortuoso ou em “saca rolha”.
1.1.5- Gastrite linfocítica: este termo se aplica a um padrão inflamatório mais do que a uma etiologia específica. Este padrão pode ser encontrado na doença celíaca, infecção por Helicobacter pylori, imunodeficiência comum variável e doença de Crohn, entre outras. Assim como em todas as doenças linfocíticas há infiltração por linfócitos em fovéolas e epitélio de superfície. Exame imunohistoquímico de CD3 pode ser necessário.
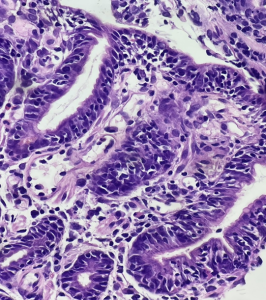
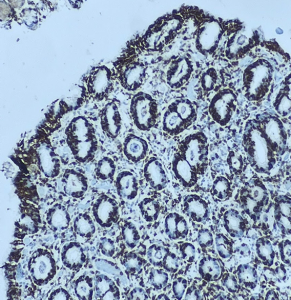
H&E. Gastrite linfocítica. Mucosa gástrica com exuberante linfocitose intraepitelial, tanto em epitélio de superfície, quanto nas glândulas. Exame imunohistoquímico complementar de CD3, mostrando positividade em linfócitos T, intraepiteliais.
1.1.6- Outras: embora menos frequentes é importante lembrar da gastrite eosinofílica e granulomatosa. A gastrite eosinofílica é caracterizada por infiltrado eosinofílico importante, envolvendo lâmina própria e epitélio e comumente está associada a doenças alérgicas e eosinofilia periférica.
As gastrites granulomatosas são descritas em doenças infecciosas, doença de Crohn, sarcoidose e em algumas populações está associada ao HP. O tipo de granuloma irá orientar a etiologia.
Gastrite aguda:
1.2.1- Definição: é a inflamação da mucosa gástrica de aparecimento súbito e curta duração.
1.2.2- Etiologia: as lesões agudas se devem ao abuso de álcool, infecções (H. Pylori, CMV) medicamentos como anti-inflamatórios não esteroides e antibióticos, estados de estresse.
1.2.3- Quadro histológico: edema, sinais de hemorragia recente, intensa congestão vascular e infiltrado inflamatório de fase aguda com erosões, úlceras e focos de necrose. Com a retirada do agente etiológico a mucosa costuma se regenerar rapidamente.
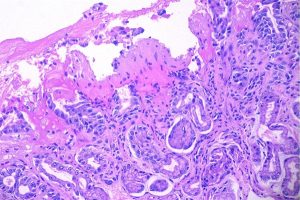
Mucosa gástrica com padrão agudo de agressão caracterizado por erosão e escasso infiltrado inflamatório na lâmina própria
Úlcera péptica
1.3.1 Definição: é a destruição da arquitetura da mucosa gástrica pelo desequilíbrio entre os mecanismos de defesa da mucosa gastroduodenal e as forças lesivas do ácido gástrico e da pepsina, combinadas com lesão superposta por agentes ambientais ou imunológicos.
1.3.2- Etiologia: Helicobacter pylori, uso de anti-inflamatórios não esteroides, principalmente a aspirina, estados de estresse, etilismo e tabagismo.
1.3.3- Quadro histológico: presença luminal de fibrina e restos celulares e necróticos associados a uma base constituída por tecido de granulação, edematoso, com neoformação vascular, endotélio reativo e reação fibroblástica. Na fase de reparação o epitélio adjacente apresenta hiperplasia foveolar reativa com atipias citológicas. Nesta fase pode ser difícil fazer o diagnóstico diferencial com displasia. A atipias citológicas podem incluir pseudoestratificação e irregularidade nuclear porém não é observado pleomorfismo, nem mitoses atípicas. Em estágios tardios pode se observar a retração cicatricial caracterizada pelo depósito de fibras de colágeno e epitélio hiperplásico.
2. LESÕES MEDICAMENTOSAS
2.1- Ferro: associado ao uso de suplementos de ferro
2.1.1 Aspectos histológicos: presença de cristais amarelo-acinzentados na superfície luminal e lâmina própria. A mucosa adjacente apresenta focos de erosão, exsudato, pequenos vasos trombosados e regeneração foveolar. É necessária a realização da coloração histoquímica de Perls que confirma os depósitos de ferro ao tingir os cristais de azul.
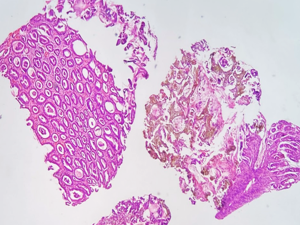
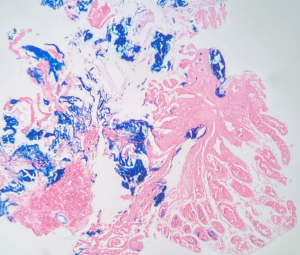
Gastrite associada a cristais de ferro. A mucosa gástrica exibe intensas alterações reativas de padrão reativo, associado à presença de cristais acastanhados na coloração de H&E e positivos (em azul) na coloração de Perls, ressaltando o acúmulo de cristais de ferro.
2.2- Kayexalate: medicamento usado para o manejo da hipercalemia em insuficiência renal.
2.2.1- Aspectos histológicos: A agressão à mucosa está associada à resina associada e se apresenta como cristais brilhantes basofílicos, poligonais, com padrão em mosaico que lembra escamas de peixe, no meio a um leito de úlcera com alterações de padrão agudo e isquêmico associado. Embora o aspecto seja característico no H&E, na realização de PAS/Alcian blue os cristais assumem coloração vermelha.
2.3- Sevelamer: fármaco quelante de fosfato usado para prevenir a hiperfosfatemia em pacientes com insuficiência renal crónica.
2.3.1- Aspectos histológicos: presença de cristais magenta e amarelados, irregulares, poligonais com aspecto em mosaico e escamas de peixe.
3. PROTOCOLO OLGA (Operative link for gastritis assessment):
Definição: sistema criado por um grupo internacional de gastroenterologistas e patologistas para proporcionar informações prognósticas: fornecer uma avaliação imediata da gravidade da doença, com especial referência ao risco de câncer.
3.2 Metodologia: é um sistema de estadiamento histológico, que combina diferentes topografias. A amostragem deverá ser realizada da seguinte forma:
- 3 amostras enviadas em frascos diferentes:
- 2 fragmentos de antro
- 2 fragmentos de corpo
- 1 fragmento de incisura
A atrofia avaliada inclui os padrões metaplásicos intestinal e pseudopilórico (unicamente aplicável em mucosa corpórea) e o padrão não metaplásico (ausência de glândulas). A atrofia deverá ser avaliada em cada amostra, contando o número de glândulas de padrão atrófico e referida em graus, porcentagem e escore (A0, A1, A2 e A3 para o antro e C0, C1, C2, C3 para corpo):
- Ausente (A0) ou (C0)
- Grau leve: <30% (A1) ou (C1)
- Grau moderado 30-60% (A2) ou (C2)
- Grau acentuado >60% (A3) ou (C3)
O estágio de gastrite resulta da combinação da extensão da atrofia pontuada histologicamente com a topografia de atrofia identificada através de mapeamento de biópsia.
Define 5 estágios (0 – IV):
I e II: baixo risco
III e IV: alto risco
O estágio OLGA deve ser dado como a declaração final do relatório histológico.
Observação:
. Em caso de amostras incompletas, amostras com mucosa intensamente inflamadas ou amostra de antro contaminada com mucosa corpórea não será possível a realização do protocolo OLGA. Sugere-se reportar a presença ou não de atrofia e graduar, porém não será possível a realização do estadiamento do protocolo.
4. LAUDO ANATOMOPATOLÓGICO
Sugestão de itens para avaliação:
Gastrite crônica com as seguintes características:
|
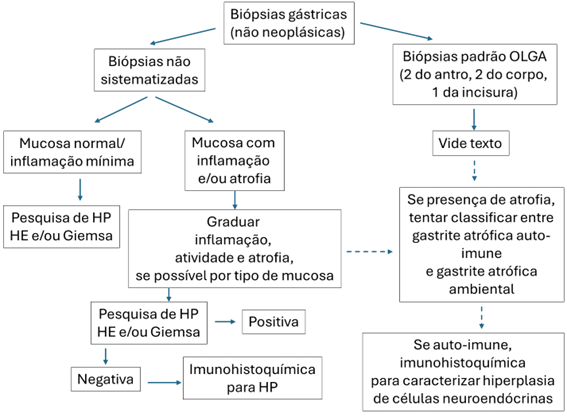
Fluxograma de ação para as situações mais comuns em biópsias gástricas não neoplásicas:

Neoplasias Gástricas
As neoplasias gástricas podem trazer grandes desafios desde o ponto de vista clínico e patológico.
Segundo a última classificação da OMS, publicada em 2017, as neoplasias gástricas são classificadas de acordo com a sua origem. Desta forma as neoplasias epiteliais são separadas das neoplasias mesenquimais e as neoplasias neuroendócrinas possuem uma categoria específica, respeitando a classificação proposta para o tubo digestivo, proposta também pela OMS.
Para fins de classificação e estadiamento, neste capítulo serão abordadas as neoplasias gástricas e de junção esôfago-gástrica.
1. Adenocarcinomas
Etiologia:
O câncer gástrico e de junção esôfago gástrica constituem a 5ª causa de morte relacionada ao câncer no mundo. Os fatores de risco associado a câncer gástrico esporádico, não hereditário, incluem causas infecciosas como Helicobacter pylori e o vírus do Epstein-Barr, dieta rica em nitritos, carnes vermelhas, álcool e obesidade.
O câncer gástrico familiar está associado principalmente a 3 síndromes: Câncer gástrico hereditário difuso (mutação do CDH1), síndrome de polipose gástrica proximal.
1.1.Subtipos histológicos:
1.1.1 Classificação de Laurén:
- Intestinal: subtipo histológico que agrupa as formas tubulares e papilíferas. A forma tubular apresenta lúmens glandulares de tamanhos variados, por vezes formando estruturas cribriformes. A forma papilar é caracterizada por projeções filiformes de células epiteliais bem diferenciadas dispostas em torno de núcleos fibrovasculares. O estroma é tipicamente desmoplásico.
- Difuso: carcinoma composto por células pouco diferenciadas, por vezes isoladas ou em pequenos grupamentos. As células podem conter citoplasma eosinofílico ou rico em mucina (células em anel de sinete), assim como citoplasma escasso por vezes imperceptível.
1.1.2. Classificação da organização Mundial da saúde:
- Tubular: presença de glândulas tubulares ramificadas com lúmens de diferentes diâmetros, compostos por células com núcleos por vezes alongados por vezes arredondados e hipercromáticos com pseudoestratificação, que chegam até o topo do lúmen. São visualizadas figuras de mitoses atípicas e presença de debri e necrose luminal
- Papilífero: tumor de crescimento exofítico, com projeções viliformes compostos por células colunares e cuboidais atípicas, sob um eixo fibrovascular.
- Mucinoso: definido pela presença de mais de 50% de mucina extracelular e células mucinosas malignas. O componente epitelial pode ter estruturas glandulares, tiras de epitélio ou células soltas (incluindo células em anel de sinete)
- Células pouco coesas: presença de células neoplásicas isoladas ou em pequenos grupamentos com glândulas mal formadas. Este grupo compreende não só o tipo células em anel de sinete (caracterizada por mucina citoplasmática com rejeição do núcleo para a periferia das células) mas inclui subtipos como plasmocitoide, histiocitoide e outros tipos com células com núcleos bizarros e citoplasma escasso. Estes tumores podem ter padrão de infiltração submucosa/transmural sem a evidência de lesão macroscópica na superfície epitelial.
| Classificação de Laurén | Classificação da organização Mundial da saúde (OMS) |
| Intestinal | Tubular (bem e moderadamente diferenciado)
Papilífero |
| Difuso | Carcinoma de células pouco coesas (incluindo células pouco coesas e outras variantes) |
| Misto | Misto |
| Indeterminado | Tubular (pouco diferenciado, formação de blocos sólidos) |
| Intestinal/difuso/indeterminado | Mucinoso |
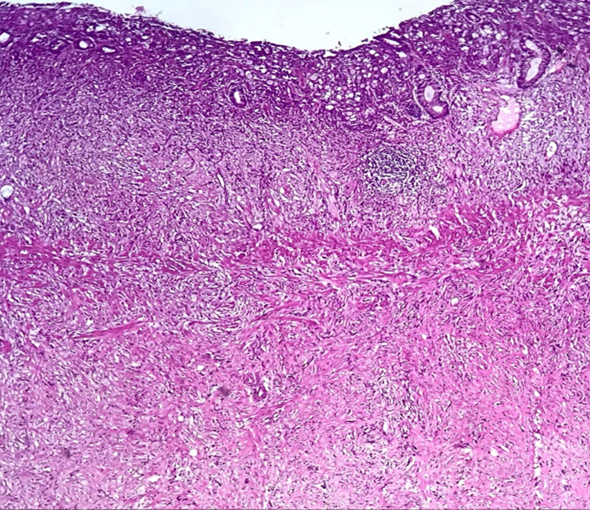
Carcinoma de células pouco coesas. Observa-se infiltração transmural difusa da parede gástrica por células isoladas, sem arranjos glandulares em meio a reação desmoplásica intensa.
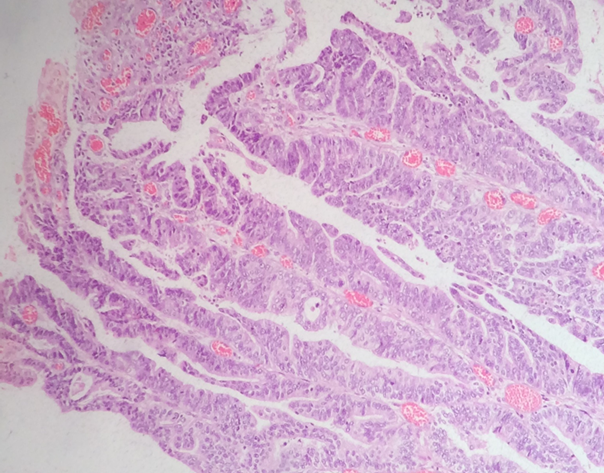
Adenocarcinoma gástrico subtipo papilífero. Observa-se a presença de papilas/formações digitiformes, com eixos vasculares na lâmina própria.
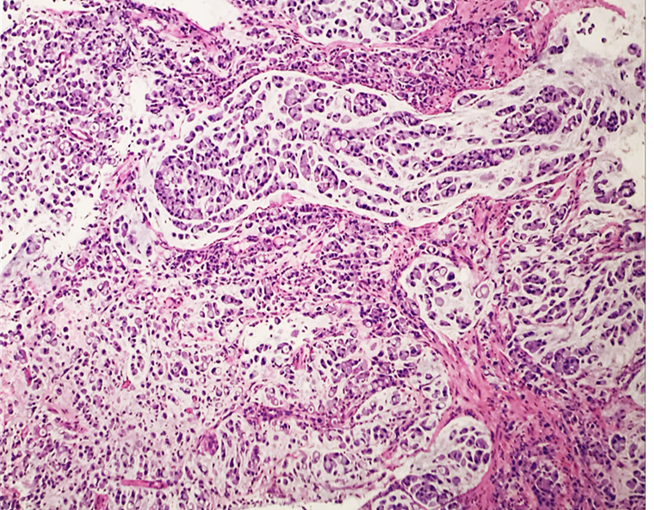
C – Adenocarcinoma de tipo difuso/Carcinoma de células pouco coesas com células em anel de sinete. C- Neoplasia rica em células mucinosas em meio a lagos de mucina. D- Imagem clássica de células em anel de sinete com citoplasma rico em mucina, rejeitando o núcleo para periferia.
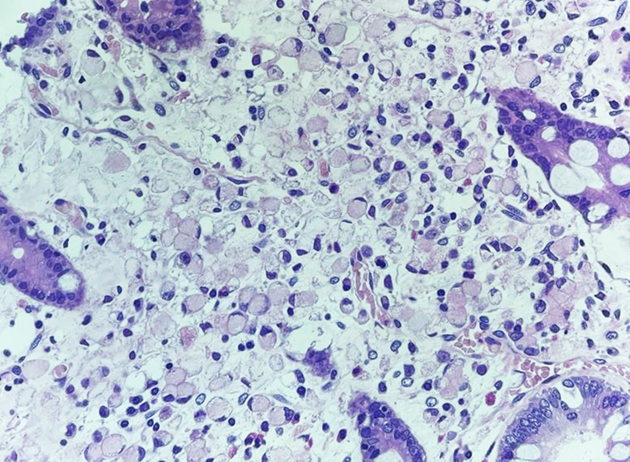
D- Adenocarcinoma de tipo difuso/Carcinoma de células pouco coesas com células em anel de sinete. C- Neoplasia rica em células mucinosas em meio a lagos de mucina. D- Imagem clássica de células em anel de sinete com citoplasma rico em mucina, rejeitando o núcleo para periferia.
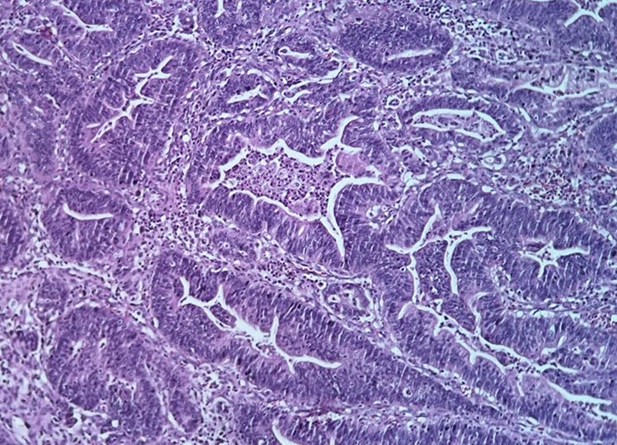
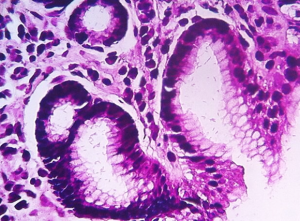
Adenocarcinoma de tipo intestinal de Lauren, tubular da OMS. Observa-se formações tubulares, por vezes complexas, com debri luminal.
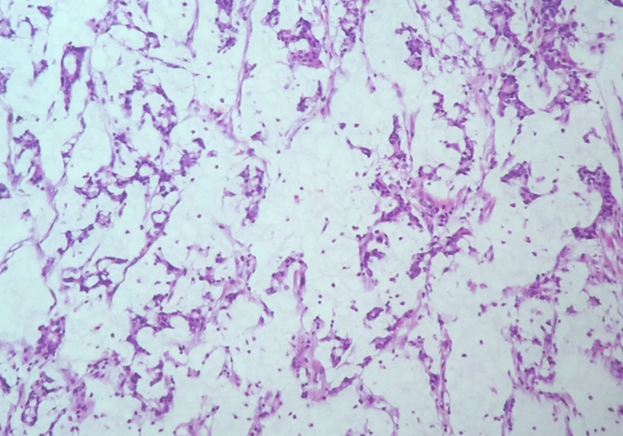
Adenocarcinoma mucinoso. Neoplasia constituída por exuberantes lagos de mucina, com presença de células neoplásicas de permeio.
Outros subtipos histológicos:
|
1.2. Grau histológico:
Nos adenocarcinomas o grau de diferenciação está baseado na porcentagem de formação de glândulas.
|
1.3. Laudo anatomopatológico sugerido para material de biópsia:
- Designação do material e topografia
- Tipo e subtipo histológico (classificação da OMS e Lauren)
- Grau de diferenciação histológica
- Nível de infiltração na amostra
- Invasão angiolinfática e perineural (sempre que possível)
- Mucosa adjacente
- Pesquisa de Helicobacter pylori
1.4. Laudo anatomopatológico sugerido para material de gastrectomias e mucosectomias:
- Tipo de procedimento realizado
- Tipo e subtipo histológicos
- Grau histológico
- Nível de invasão
- Tamanho
- Localização
- Invasão angiolinfática
- Invasão perineural
- Infiltrado inflamatório peritumoral
- Efeitos de resposta à neoadjuvância (tabela)
- Margens cirúrgicas:
- Relatar o status das margens e distância do tumor
- Gastrectomias: proximal, distal e omental
- Mucosectomias: laterais e profunda
- Relatar o status das margens e distância do tumor
- Linfonodos
- Relatar o número de linfonodos comprometidos e número de linfonodos dissecados.
- Sempre que os linfonodos vierem dissecados separadamente por cadeias, as mesmas devem ser reportadas por separado.
- Depósitos tumorais (definidos como nódulos tumorais discretos dentro da área de drenagem linfática de o carcinoma primário sem tecido linfonodal identificável ou estrutura vascular e neural identificável), serão consideradas metástases linfonodais regionais para fins de estadiamento.
- Estadiamento patológico: seguindo a versão mais recente da AJCC.
1.5. Biomarcadores:
Her-2: O teste pode ser realizado por imunohistoquímica e será reportado em cruzes, sendo o escore 3+ interpretado como positivo. Para o escore 2+ (duvidoso) é necessária a realização de pesquisa por métodos de hibridização in situ (vide Her-2 para transição esôfago-gástrica).
IMS: O teste para deficiência das proteínas dos genes de reparo (MMRp) é realizado por imuno-histoquímica e a instabilidade microssatélite (MSI) por PCR ou sequenciamento (NGS). O teste de imuno-histoquímica representa um excelente método de testagem de primeira linha. Analisa a expressão nuclear de 4 proteínas de reparo (MLH1, PMS2, MSH2 e MSH6). Este método apresentou alta taxa de concordância (90%), semelhante à deteção de MSI utilizando PCR.
Na interpretação se a expressão estiver mantida significa que o processo MMR está intacto (MMRp), no entanto, a perda de expressão de qualquer uma destas quatro proteínas indica dMMR.
A amplificação por PCR permite a detecção de MSI comparando e medindo por eletroforese o tamanho dos fragmentos de DNA amplificados do tumor e das amostras normais do mesmo paciente.
PD-L1: usado como biomarcador preditivo de resposta a imunoterapia. O teste pode ser realizado por imuno-histoquímica, sendo necessário um mínimo de 100 células tumorais viáveis e será reportado sob a forma de CPS (escore combinado positivo) que é calculada como o número de células com coloração PD-L1 (células tumorais, linfócitos, macrófagos) dividido pelo número total de células tumorais viáveis, multiplicado por 100. As células tumorais podem mostrar coloração de membrana parcial ou completa convincente de qualquer intensidade e linfócitos e macrófagos dentro dos ninhos tumorais e/ou estroma de suporte adjacente mostrando coloração de membrana e/ou citoplasmática convincente também de qualquer intensidade. Na fórmula devem ser excluídas células tumorais não coradas, células tumorais com coloração apenas citoplasmática, células displásicas, carcinoma in situ, áreas de necrose e todos os tipos de células inflamatórias, que não estejam associadas ao estroma de suporte.
Claudina: A avaliação de Claudina 18,2 pode ser realizada através do método imuno-histoquímico. A marcação é de membrana (lateral, basolateral, apical e microluminal), reportada em cruzes. A marcação forte e completa é relatada como 3+, a marcação incompleta como 2+ e marcação fraca e incompleta como 1+. Definindo como positivo aqueles casos onde a somatória de áreas 2 e 3+ seja ≥75% das células tumorais avaliadas.
EBV: A avaliação de expressão de associação ao Epstein-Barr vírus deve ser solicitada principalmente no tipo histológico medular ou tumores com intenso infiltrado linfocitário intratumoral e peritumoral. Embora haja várias formas de testagem, a hibridização in situ (EBER ISH) é amplamente utilizada e considerada o padrão ouro para detecção e localização de EBV latente em amostras de tecido.

