Autores
Raimundo Gerônimo da Silva Júnior, Laura Carolina López Claro, Aloísio Souza Felipe da Silva, Cleto Dantas Nogueira, Emilio Augusto Campos Pereira de Assis, Evandro Sobroza de Mello, Igor Campos da Silva.
1. Amostragem endoscópica
A coleta e o manuseio adequados de amostras de tecido durante a endoscopia são fundamentais para o diagnóstico de patologias do sistema digestivo. A seguir, são apresentadas algumas recomendações de amostragem endoscópica para as condições mais comuns do esôfago.
Esofagite eosinofílica:
Recomenda-se a coleta de pelo menos seis biópsias do esôfago (2-4 do esôfago distal e 2-4 do proximal), priorizando áreas anormais.
Doença do refluxo gastroesofágico (DRGE):
Não é recomendado realizar biópsias com o objetivo de diagnóstico em pacientes com achados endoscópicos normais.
Esofagite viral:
Recomenda-se a coleta de seis biópsias, incluindo da base e borda das úlceras.
Câncer esofágico avançado:
Recomenda-se pelo menos seis biópsias.
Lesões esofágicas ressecáveis:
Recomenda-se a coleta de uma ou duas biópsias com o objetivo de não comprometer a ressecção endoscópica.
As amostras devem ser acondicionadas em frascos separados, devidamente identificados, e fixadas em formalina tamponada a 10%.
É importante que as amostras sejam acompanhadas de uma requisição preenchida com informações clínicas detalhadas, incluindo a história da doença atual e os achados endoscópicos.
2. Anatomia e histologia
O esôfago mede cerca de 25cm e é composto de três porções: cervical (superior), média e torácica inferior.
Frequentemente, amostras esofágicas são recebidas com a localização em centímetros, medida a partir dos dentes incisivos. Nos homens, a junção esôfago-gástrica está aproximadamente a 40cm.
Histologicamente, o esôfago apresenta quatro camadas bem definidas: mucosa, submucosa, muscular própria e adventícia. A mucosa consiste em epitélio, lâmina própria e muscular da mucosa.
Biópsias esofágicas geralmente não apresentam a lâmina própria. Normalmente, ela só é observada quando há dano significativo à mucosa. É importante não confundir a lâmina própria com a submucosa, especialmente ao avaliar casos de carcinoma invasivo inicial.
3. Esofagite aguda:
Definição: É uma inflamação súbita e de curta duração do esôfago.
Etiologia: As principais causas incluem: DRGE, infecções e agentes químicos ou medicamentosos.
Achados histopatológicos: O padrão de esofagite aguda é caracterizado pela presença de neutrófilos intraepiteliais com ou sem erosão e/ou ulceração.
Não é incomum a coexistência com outras patologias, especialmente em pacientes com DRGE.
A presença de “padrão misto de lesão” deve ser um alerta para possibilidade de lesão relacionada à medicação. Em particular, se a história clínica indicar controle satisfatório do refluxo. Nestes casos, uma etiologia alternativa para ulceração deve ser considerada
Em biópsia com ulceração, é possível observar alterações reativas de células estromais, que podem mimetizar sarcoma ou carcinoma sarcomatoide.
3.1. Esofagite por Cândida
Achados endoscópicos: Placas brancas facilmente removíveis, revelando mucosa subjacente eritematosa ou ulcerada.
Achados microscópicos: Presença de hifas e esporos em meio a debris queratínicos, podendo ser visto esofagite ativa ou necrose/ulceração. Caso não sejam detectadas hifas na coloração de hematoxilina-eosina, recomenda-se a realização de colorações especiais como PAS (Periodic-Acid-Sciff) ou GMS (Grocott-Gomori Methenamine Silver) nas seguintes situações:
- Suspeita clínica de candidíase;
- Inflamação aguda intensa;
- Paraqueratose proeminente.
A presença de infiltrado neutrofilico superficial, na ausência de hifas, é um achado sugestivo de infecção por cândida.
Vale ressaltar que, em casos de reinfecção por cândida, a paraqueratose pode ser o único achado, sem qualquer componente neutrofílico.
3.2. Esofagite por Herpes
Achados endoscópicos: Ulceração rasa e vesículas
Achados microscópicos: Úlcera com exsudato necrótico e efeito citopático viral nas células epiteliais, as quais exibem:
- Marginação cromatínica;
- Multinucleação;
- Amoldamento nuclear.
3.3. Esofagite por citomegalovírus (CMV)
Achados endoscópicos: eritema, erosão e ulceração.
Achados microscópicos: Úlcera com esofagite ativa e efeito citopático viral em células mesenquimais, caracterizado por:
Citomegalia e Corpos de inclusões virais densamente eosinofilica com halo perinuclear, conferindo aparência de “olho de coruja”.
Essas alterações podem ser vistas em células endoteliais, epitélio colunar e células estromais. Amostragem da base da úlcera é essencial para detecção do CMV.
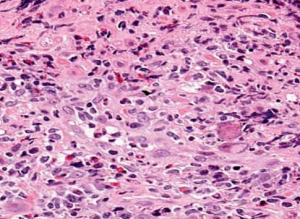
Mucosa esofágica ulcerada com tecido de granulação e efeito citopático viral com células estromais densamente eosinofilica com halo perinuclear
3.4 Esofagite medicamentosa
Achados endoscópico: Ulceração.
Achados microscópicos:
- Anti-inflamatórios não hormonais (AINEs): Presença de neutrófilos intraepiteliais, com ou sem erosão e/ou ulceração.
- kayexalate (usado para reduzir potássio sérico em pacientes com insuficiência renal): Cristais de cor roxa, com aparência rachada.
- Doxiciclina: Ulceração com necrose fibrinoide vascular e microtrombos.
- Medicamento com ferro: Pigmento férrico incrustado em crostas fibrinoleucocitárias e alterações reativas epiteliais. A utilização da coloração de Perls pode ser útil na caracterização.
4. Doença do Refluxo gastro-esofágico (DRGE)
Definição: A DRGE é uma condição crônica em que o conteúdo gástrico, principalmente ácido, reflui para o esôfago, causando sintomas e/ou complicações.
Etiologia: É multifatorial e envolve uma combinação de fatores como: Disfunção do esfíncter esofágico inferior, hérnia de hiato, alteração da motilidade esofágica, obesidade, gravidez, dieta e hábitos de vida e uso de medicamentos.
Achados microscópicos:
- Hiperplasia de células basais: Camada basal maior que 15% da espessura epitelial ou com 5 a 6 camadas de células.
- Eosinófilos intraepiteliais: Mais que 1-2 eosinófilos por campo de grande aumento (CGA).
- Espaços intercelulares dilatados.
- Alongamento das papilas da lâmina própria: Papilas se estendem além de 50% da espessura epitelial.
- Outros achados incluem: Balonização celular, vacuolização de queratinócitos, linfocitose intraepitelial, dilatação vascular.
Observações importantes:
- Abscessos e degranulação de eosinófilos não são achados frequentes de DRGE, sendo mais associados a esofagite eosinofílica (ver próximo tópico).
- Neutrófilos ocasionais podem estar presentes e são mais frequentes em casos de agressão epitelial severa, como nas situações que envolvem erosões e úlceras.
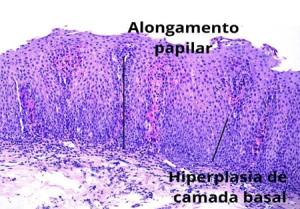
Figura: Esofagite crônica em paciente com DRGE. Alongamento de papila da lâmina própria e hiperplasia de células basais (10X).
5. Esofagite eosinofilica (EoE)
Definição: É uma doença esofágica crônica mediada por uma resposta imune, clinicamente caracterizada por sintomas relacionados à disfunção esofágica e, histologicamente, por infiltração significativa de eosinófilos.
Etiologia: É complexa e envolve fatores genéticos, ambientais e imunológicos, incluindo alergias alimentares, atopia, dismotilidade esofágica e outros fatores ambientais.
Achados microscópicos:
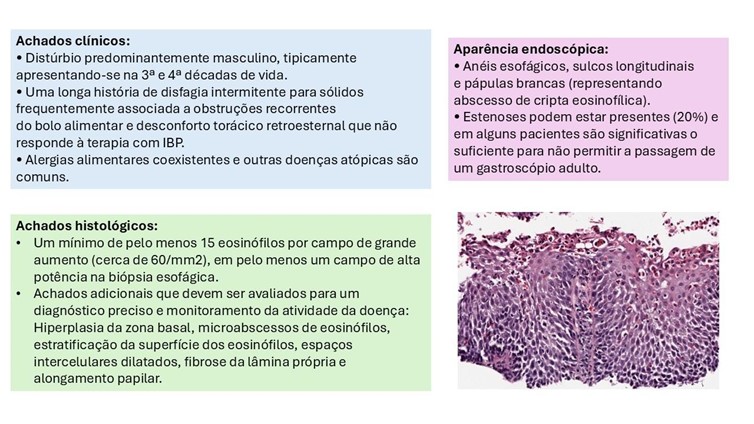
Um diagnóstico conclusivo de EoE requer a presença de sintomas relacionados à disfunção esofágica e histologia mostrando ≥15 eosinófilos/CGA (cerca de 60 eosinófilos/mm2) em pelo menos uma biópsia esofágica.
Além da contagem de eosinófilos, características histológicas adicionais da EoE que devem ser avaliadas e relatadas, para um diagnóstico preciso e monitoramento da atividade da doença, incluem:
- Hiperplasia da zona basal;
- Microabscessos de eosinófilos;
- Distribuição anormal (linear) de eosinófilos na superfície;
- Espaços intercelulares dilatados;
- Fibrose da lâmina própria;
- Alongamento papilar.
6. Esofagite Linfocítica
Definição: Este termo descreve mais um padrão de agressão esofágica do que um diagnóstico específico.
Etiologia: Este padrão pode ser observado em DRGE, doença de Crohn, doença celíaca, acalasia e outras dismotilidades, líquen plano e doença do enxerto versus hospedeiro.
Achados microscópicos:
Os critérios diagnósticos propostos incluem:
– Denso infiltrado linfocitário peripapilar;
– Espongiose peripapilar envolvendo os 2/3 superiores do epitélio;
– Ausência de infiltrado neutrofílico e eosinofílico significativo.
Geralmente observamos cerca de 20 linfócitos/CGA em área interpapilar e 50-55 linfócitos/CGA em área papilar.
6.1. Esofagite liquenoide
Este padrão caracteriza-se, além da linfocitose intraepitelial, por um infiltrado liquenoide de linfócitos T, paraqueratose, corpos de Civatte e acantose.
Este padrão tem sido associado a líquen plano cutâneo, medicamentos,infecção viral e doenças reumatológicas.
Como displasia e carcinoma escamoso tem sido associado com líquen plano, pacientes com este padrão de agressão esofágica merecem acompanhamento. Deve-se informar no laudo a presença ou ausência de displasia.
Se, além de linfocitose, há conspícuos corpos apoptóticos, deve-se considerar, dependendo do contexto clínico, doença do enxerto versus hospedeiro.
7. Esofagite dissecante superficial
Definição: O padrão de esofagite descamativa (Sloughing esophagitis) caracteriza-se por descamação do epitélio para lúmen,observada durante endoscopia
Etiologia: Este padrão é associado a condições como debilitação, alcoolismo, injúria térmica e uso de múltiplos medicamentos.
Achados microscópicos:
- Epitélio com aparência em dois tons: Na superfície, epitélio hipereosinofílico/ necrótico com paraqueratose; abaixo, epitélio não inflamado ou minimamente inflamado com reatividade de camada basal.
- Presença de fenda na metade do epitélio, resultando em destacamento de fragmentos necróticos.
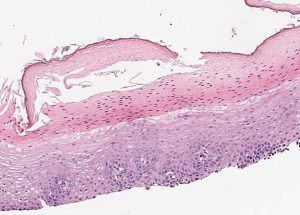
Esofagite descamativa – Aparência da mucosa em dois tons, com uma zona superficial eosinofílica que também apresenta núcleos picnóticos ou necróticos e uma zona basal de aparência mais normal.
8. Esôfago de Barrett
Definição: O Colégio Americano de Gastroenterologia (2016) define esôfago de Barrett como: extensão de mucosa de coloração salmão que se projeta no esôfago tubular, com > 1cm de extensão proximal à junção esôfago-gástrica e confirmação por biópsia de metaplasia intestinal.
Etiologia: Os fatores de risco incluem DRGE, sexo masculino, obesidade central, fumo e idade acima de 50 anos.
Achados microscópicos:
Uma vez que o diagnóstico, em contexto endoscópico adequado, baseia-se na identificação de metaplasia intestinal, é fundamental caracterizar células caliciformes verdadeiras e diferenciá-las de pseudocélulas caliciformes.
- Células caliciformes verdadeiras: Encontradas isoladamente entre células absortivas e foveolares, com citoplasma que contém mucina ácida (cor margenta no PAS/AB).
- Pseudocélulas caliciformes: São células foveolares com distensão citoplasmática por mucina neutra, que tendem a se agrupar.
Ao analisar amostras encaminhadas para avaliar ou afastar a possibilidade de esôfago de Barrett, é importante identificar qual o tipo epitelial é encontrado, que pode incluir:
- Mucosa oxíntica;
- Mucosa da cárdia;
- Heterotopia / metaplasia pancreática;
- Epitélio em multicamada;
- Ductos esofágicos.
Se epitélio em multicamadas ou ductos esofágicos forem observados, isso confirma que a amostra é de origem esofágica.
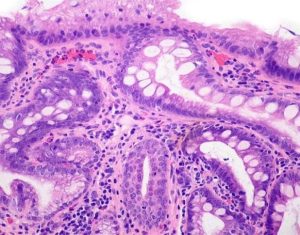
Amostra com extensa metaplasia intestinal e no centro um ducto esofágico, confirmando topografia esofágica.
A correlação clínico-endoscópica é importante para avaliação diagnóstica e elaboração do relatório histopatológico. A seguir, três cenários com sugestões para diagnóstico e comentário.
Cenário 1: Amostra de esôfago distal sem informes endoscópicos, e há metaplasia intestinal:
Diagnóstico:
Esôfago de Barrett.
Negativo ou positivo para displasia.
Comentário: De acordo com as diretrizes do Colégio Americano de Gastroenterologia (2016), o diagnóstico de esôfago de Barrett baseia-se na identificação de células caliciformes, presumindo-se que a amostra foi coletada do esôfago distal e que a irregularidade da mucosa se estende pelo menos 1cm acima do topo da prega gástrica.
Cenário 2: Amostra descrita como sendo de esôfago distal, com informe endoscópico indicando que a alteração da mucosa se estende > 1cm proximal à junção esôfago-gástrica, e há metaplasia intestinal.
Diagnóstico:
Esôfago de Barrett.
Negativo ou positivo para displasia.
Cenário 3: A amostra identificada como da junção esôfago-gástrica, sem informes endoscópicos, e há metaplasia intestinal.
Diagnóstico: Biópsia da junção gastro-esofágica:
Mucosa do tipo cárdia com metaplasia intestinal.
Negativo para displasia.
Comentário: Se a biópsia foi coletada do esôfago tubular e a irregularidade da mucosa se estende pelo menos 1cm acima do topo da prega gástrica, tais achados representam esôfago de Barrett. Caso a amostra tenha sido coletada da cárdia, representa mucosa do tipo cárdia com metaplasia intestinal.
9. Displasia em esôfago de Barrett
Na avaliação de displasia, é importante atenção para os seguintes achados:
- Maturação superficial: A razão núcleo:citoplasma da superfície é mais baixa do que nas glândulas profundas.
- Arquitetura glandular: Aglomerados de glândulas aparentemente normais são anormais. A presença de glândulas cribrifomes, dilatação cística e debris necróticos luminais indica severa alteração arquitetural.
- Achados citológicos: Atipia citológica pode indicar displasia, alteração reparativa ou ser inerente às glândulas profundas do esôfago de Barrett (avalie a polaridade nuclear).
9.1. Negativo para displasia:
- Maturação superficial com polarização preservada, mostrando quatro linhas (ver figura abaixo)
- Arquitetura normal com abundante lâmina própria.
- Ausência de atipias citológicas com manutenção da polaridade nuclear.
Recomenda-se vigilância endoscópica a cada 3-5 anos.
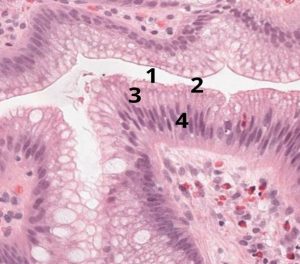
- Capa de mucina neutra
- Base da capa de mucina superficial
- Citoplasma
- Núcleos estratificados
9.2. Indefinido para displasia:
Usado quando há incerteza se as alterações (aumento/hipercromasia nuclear) são reativas ou neoplásicas.
- Inflamação presente pode obscurecer tais achados.
- Artefatos técnicos/térmicos limitando a interpretação
- Alteração citológica em componente epitelial mais profundo que sugere displasia, mas com maturação preservada.
Nestes casos recomenda-se tratar para DRGE e repetir biópsias em 3-6 meses.
9.3. Displasia de baixo grau (Tipo adenoma ou intestinal)
- A superfície epitelial tem aparência similar às glândulas mais profundas, com lâmina própria presente entre as glândulas.
- Alteração citológica se estende à superfície, com núcleos hipercromáticos e levemente aumentados, com ou sem estratificação e perda de mucina.
- A transição abrupta entre epitélio displásico e não displásico é sugestiva de displasia.
- As quatro linhas (Ver figura acima) são perdidas.
Alguns casos de displasia de baixo grau são indistinguíveis de adenoma tubular convencional. Recomenda-se evitar o termo “adenoma tubular”. O termo preferido é displasia epitelial polipóide de baixo grau.
Estes casos são manejados com ablação endoscópica da mucosa
9.4. Displasia de alto grau:
- Ausência de maturação superficial.
- Alteração arquitetural com aglomerados de glândulas anormais.
- Células marcadamente aumentadas e hipercromáticas, que se estendem à superfície, com perda de polaridade nuclear.
9.5. Displasia foveolar (não-intestinal)
- Poucas ou ausentes células caliciformes
- Caracterizada por camada única de células colunares tipo foveolar com abundante mucina citoplasmática
- Núcleos aumentados, levemente hipercromáticos, sem estratificação
- Displasia de alto grau caracteriza-se por marcado aumento no tamanho nuclear, cromatina vesiculosa, proeminente nucléolo e frequentes mitoses.
9.6. Displasia de criptas basais
- Marcada atipia nas criptas basais com maturação preservada na superfície.
- A expressão imuno-histoquímica aberrante para p53 é considerada significante para o diagnóstico de displasia.
10. Carcinoma de células escamosas (CEC)
Definição: Neoplasia epitelial esofágica maligna, caracterizada por diferenciação de células escamosas com queratinócitos com pontes intercelulares e/ou queratinização. É a sexta principal causa de morte relacionada ao câncer no mundo.
Achados clínicos: O sintoma clínico mais comum do carcinoma espinocelular esofágico é a disfagia, frequentemente indicando doença em estágio avançado. Outros sintomas podem incluir dor torácica, odinofagia e perda de peso significativa e rouquidão (mais comum no CEC de esôfago superior).
Fatores de risco: Uso de tabaco e álcool, baixo status socioeconômico, consumo de bebidas muito quentes, fatores dietéticos, índice de massa corporal elevado, fatores genéticos e condições médicas associadas como síndrome de Plummer-Vinson, acalasia, radioterapia e ingestão de cáusticos.
Achados macroscópicos: Segundo a Sociedade esofágica Japonesa, os tumores são macroscopicamente classificados nestes tipos:
- Tipo 0: Superficial
- Tipo 1: Protruso
- Tipo 2: Ulcerativo e localizado
- Tipo 3: Ulcerativo e infiltrativo
- Tipo 4: Difusamente infiltrativo
Achados microscópicos:
A graduação é baseada no grau de atipia citológica, atividade mitótica e presença de queratinização.
O carcinoma espinocelular do esôfago é frequentemente graduado utilizando um sistema de três graus: bem diferenciado (G1), moderadamente diferenciado (G2) e pouco diferenciado (G3). No entanto, um sistema simplificado de dois níveis, agrupando graus 1–2 versus grau 3, pode ter maior relevância clínica, dada a alta variação interobservador entre os graus 1 e 2.
Subtipos histológicos
- Carcinoma epidermoide verrucoso: Um carcinoma bem diferenciado, com mínimas atipias e atividade mitótica, superfície com projeções papilares e a porção invasiva caracterizada por projeções bulbosas largas.
- Carcinoma sarcomatoide: Padrão de crescimento polipoide com componente epitelial escamoso neoplásico (bem a moderadamente diferenciado ou in situ) e de células fusiformes (de alto grau, podendo mostrar diferenciação óssea, cartilaginosa ou muscular esquelética).
- Carcinoma escamoso basaloide: Padrão de crescimento em blocos sólidos de células basaloides, por vezes com comedonecrose e formações pseudoglandulares e cribriformes.
Estadiamento patológico:
A profundidade da invasão fornece uma divisão clinicamente relevante: doença superficial (ou precoce) versus doença avançada (ou tardia).
- Doença superficial: Invasão restrita à mucosa e à submucosa. Baixo risco de metástase para linfonodos regionais e curável por ressecção local se a invasão submucosa for < 200 μm de profundidade.
- Doença avançada: Invasão além da muscularis própria, com alto risco de metástase regional ou sistêmica.
Prognóstico e predição
O fator prognóstico mais importante é o estadiamento, que determina o regime de tratamento mais apropriado. A doença superficial, responsável por até 35% de todos os casos no Japão, apresenta uma taxa de sobrevivência de 5 anos de aproximadamente 85%. Já a doença avançada tem uma taxa de sobrevivência de 5 anos de < 10–15%.
Inibidores de pontos de verificação imunológico representam uma abordagem promissora para o tratamento da doença avançada
11. Adenocarcinoma do esôfago e da junção esôfago-gástrica
Definição: Neoplasia maligna epitelial esofágica com diferenciação glandular ou mucinosa.
Localização:
Quase todos os adenocarcinomas ocorrem no esôfago inferior e na junção esofagogástrica, sendo rara a localização no terço médio e superior do esôfago.
Os adenocarcinomas da junção esofagogástrica, por definição, têm seu epicentro a 2 cm da junção esofagogástrica, podendo estender-se para o esôfago.
Achados clínicos e etiologia:
Os sintomas mais comuns incluem disfagia, refluxo, perda de peso e dor.
Fatores de risco incluem doença do refluxo gastroesofágico, obesidade e sexo masculino.
Achados macroscópicos:
Os adenocarcinomas esofágicos frequentemente se apresentam em estágios avançados, como lesões estenosantes, polipóides, fúngicas, ulcerativas ou infiltrantes difusas. Em estágios iniciais, podem aparecer como placas irregulares e pequenos nódulos ou não serem detectados à endoscopia.
Achados Microscópicos:
O adenocarcinoma esofágico apresenta linhagem gástrica, intestinal e mista com os seguintes padrões:
- Tubular: mais comum, caracterizado por estruturas glandulares isoladas ou anastomosadas.
- Papilar: Formações papilares; padrão micropapilar é raro.
- Mucinoso: Células neoplásicas flutuando em abundante matriz mucinosa.
- Anel de sinete: Células que lembram anéis de sinete, associadas a pior prognóstico.
A presença de achados invasivos como brotamentos tumorais (grupos isolados de 1-5 células) e glândulas irregulares anguladas na lâmina própria e muscular da mucosa devem ser estadiadas como pT1a ou carcinoma intramucoso.
Necrose luminal, nucléolo proeminente e glândulas dispostas em paralelo à superfície são outros achados de carcinoma intramucoso.
Sinais de invasão em biópsias endoscópicas: Proeminente desmoplasia e/ou extensão pagetoide de células do carcinoma para o epitélio escamoso.
A muscular da mucosa é frequentemente duplicada e espessada no contexto de esôfago de Barrett e não deve ser confundida com a camada muscular própria.
A graduação do adenocarcinoma esofágico é baseada na oitava edição do manual da American Joint Committee on Cancer (AJCC):
- Grau 1 (bem diferenciado): > 95% do carcinoma composto por glândulas bem formadas;
- Grau 2 (moderadamente diferenciado): 50–95% do carcinoma demonstrando formação glandular.
- Grau 3 (pouco diferenciado): < 50% do carcinoma demonstrando formação glandular.
Painel imuno-histoquímico para diferenciar adenocarcinoma do CEC
| Adenocarcinoma | CEC |
| CK7+ | CK7 – (geralmente) |
| CK5/6, p63 e p40 negativos | CK5/6,p63 e p40 positivos |
| Coloração de PAS e mucina positiva | Coloração de PAS e mucina negativa |
Tratamento:
A ressecção endoscópica, com ou sem ablação por radiofrequência, é o tratamento padrão para adenocarcinoma pT1, desde que não tenha achados patológicos adversos, como:
- Invasão de submucosa de mais de 500 micrômetros;
- Carcinoma pouco diferenciado;
- Invasão linfovascular;
- Margens positivas.
Os carcinomas avançados requerem esofagectomia, possivelmente precedida por quimioterapia.
Prognóstico e predição:
O parâmetro mais importante para prever o prognóstico de pacientes com adenocarcinoma esofágico é o estágio patológico.
O teste para HER2 deve ser realizado rotineiramente, e, quando amplificado, indica-se terapia com trastuzumab.
Escore imuno-histoquímico para HER2 (baseado na coloração da membrana):
0 (Negativo):
- Peça cirúrgica: Ausência de marcação ou reatividade de membrana em menos de 10% das células tumorais.
- Biópsia: Ausência de reatividade em células tumorais.
1+ (Negativo):
- Peça cirúrgica: Coloração de membrana fraca ou mal perceptiva em mais de 10% das células tumorais.
- Biópsia: Grupos de células tumorais com coloração de membrana fraca ou mal perceptiva, independentemente do percentual de células coradas.
2+ (Duvidoso):
- Peça cirúrgica: Coloração de membrana fraca a moderada, completa, basolateral ou lateral, em mais de 10% das células tumorais.
- Biópsia: Grupos de células tumorais com coloração de membrana fraca a moderada, completa, basolateral ou lateral, independentemente do percentual de células coradas.
A realização de técnica de FISH está indicada.
3+ (Positivo):
- Peça cirúrgica: Coloração de membrana forte, completa, basolateral ou lateral, em mais de 10% das células tumorais.
- Biópsia: Grupos de células tumorais com coloração de membrana forte, completa, basolateral ou lateral, independentemente do percentual de células coradas.
12. Laudo anatomopatológico sugerido para material de biópsia de carcinomas esofágicos:
- Designação do material e topografia
- Tipo e subtipo histológico (classificação da OMS)
- Grau de diferenciação histológica
- Nível de infiltração na amostra
- Invasão angiolinfática e perineural (sempre que possível)
- Mucosa adjacente
13. Laudo anatomopatológico sugerido para ressecções cirúrgicas/mucosectomia:
Aplica-se a:
1- Todos os carcinomas que surgem no esôfago
2- Carcinomas envolvendo a junção esofagogástrica (EGJ), com ponto médio do tumor ≤2 cm no estômago/cárdia proximal
3- Tumores neuroendócrinos bem diferenciados (grau 1, 2 e grau 3 da OMS)
- Procedimento realizado
- Sítio do tumor
- Relação do tumor com a junção esôfago-gástrica
- Tamanho do tumor
- Tipo histológico (OMS)
Adenocarcinoma do esôfago e junção esofagogástrica SOE
Carcinoma adenoide cístico esofágico
Carcinomas adenoescamosos e mucoepidermoides esofágicos
Carcinoma espinocelular esofágico SOE
Carcinoma indiferenciado esofágico
Neoplasias neuroendócrinas esofágicas
- Grau histológico
- Nível de invasão
- Status das margens cirúrgicas
- Esofagectomia/gastroeofagectomia: Proximal, distal e radial
- Ressecções endoscópicas: Laterais e profunda
Especificar a distância da margem mais próxima do carcinoma invasivo, bem como envolvimento por displasia e metaplasia intestinal (esôfago de Barrett).
- Invasão angiolinfática
- Invasão perineural
- Linfonodos regionais
Especificar número de linfonodos examinados e comprometidos, bem como extensão extranodal.
- Estadiamento patológico: seguir a versão mais recente da AJCC
Testes complementares/Biomarcadores:
- Her2 – Para adenocarcinomas da JEG irressecáveis ou metastáticos (ver tópico acima de adenocarcinoma)
- PDL-1
- Teste para deficiência das proteínas dos genes de reparo (MMRp) por técnica imuno-histoquímica e instabilidade microssatélite (MSI) por PCR ou sequenciamento (NGS)
- Marcadores neuroendócrinos e Ki67 para neoplasias neuroendócrinas
