Carmen Lúcia Penteado Lancellotti, Felipe D’Almeida Costa, Francine Hehn de Oliveira, Aline Helen da Silva Camacho, Jean Costa Nunes
Códigos de topografia
C70 Neoplasias das meninges
C71 Neoplasias do encéfalo
C72 Neoplasias da medula espinhal, dos nervos cranianos e de outras partes do sistema nervoso central (SNC)
- Identificação e resumo clínico
Paciente__________________________________________________
Registro_________________________
Idade______________Sexo_________Cor___________
Médico solicitante_____________________________________________
Resumo clínico ………………………………………………………………………………….
……………………………………………………………………………………………………………………………………………………………………………………………………………………
Tratamento(s) prévio(s) (cirurgias, radioterapia, quimioterapia e/ou outros)
Sim
- Não
Em caso afirmativo, descrever:
Tipo de tratamento: __________________________________
Ano do tratamento: __________________________________
- Aspectos de neuroimagem (ressonância magnética e/ou tomografia computadorizada)
II.1 Lateralidade
- Direito
- Esquerdo
II.2 Topografia
- Intra-axial
- Extra-axial
II.2.1 Para lesões intra-axiais:
II.2.1.1 Supratentorial (especificar topografia): _________________
II.2.1.2 Infratentorial (especificar topografia): ___________________
II.2.1.3 Medula espinhal (especificar nível): _____________________
II.2.2 Para lesões extra-axiais:
- Intradural
- Extradural
II.2.2.1 Supratentorial (especificar topografia): _________________
II.2.2.2 Infratentorial (especificar topografia): ___________________
II.2.2.3 Medula espinhal (especificar nível): _____________________
II.3 Hipótese diagnóstica radiológica: _______________________________
III. Procedimento cirúrgico
III.1 Tipo de procedimento
- Ressecção macroscópica total
- Ressecção parcial
- Biópsia a céu aberto
- Biópsia estereotática/neuronavegação
III.2 Hipótese diagnóstica cirúrgica intraoperatória: ____________________
III.3 Data do procedimento ____ / ____ / ____
- Exame macroscópico
IV.1 Topografia do espécime (frascos denominados conforme designação do cirurgião; no caso de tecidos diferentes no mesmo frasco, descrever separadamente cada tipo de tecido).
IV.2 Espécime cirúrgico
Dimensão da peça _____ x _____ x _____ cm
Peso _____ g
Coloração: ____________________________
Consistência: __________________________
IV.3 Amostragem do espécime (figura 1)
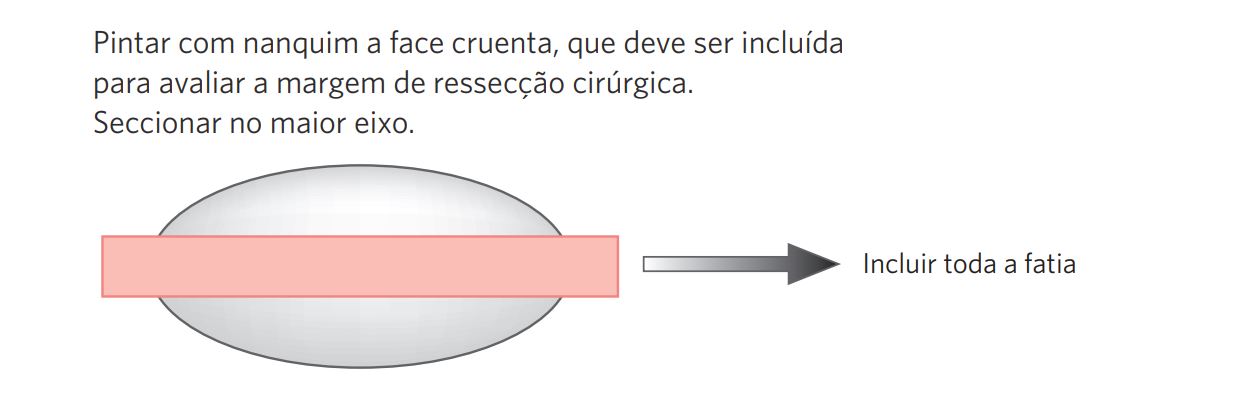
Figura 1 – Procedimento para amostragem das peças cirúrgicas.
Se necessário, seccionar em cortes transversais e incluir todas as fatias (figura 2).
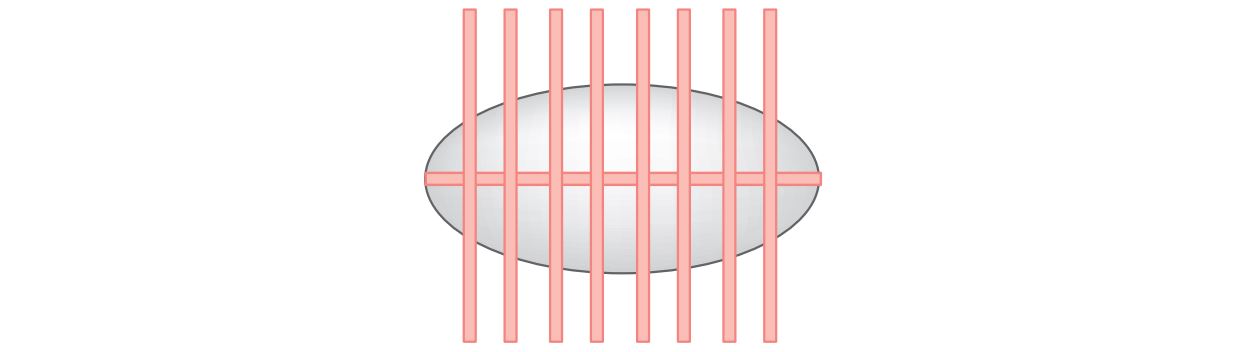
Figura 2 – Cortes transversais para obtenção de múltiplas amostragens da peça cirúrgica.
Nota: Em razão da heterogeneidade tumoral, sugere-se incluir todo o espécime.
- Exame microscópico
V.1. Modelo de diagnóstico integrado:
Primeira linha: Diagnóstico integrado (incorporando toda a informação das avaliações realizadas no tecido).
Segunda linha: Classificação histopatológica (ver item V.2).
Terceira linha: Graduação histopatológica (ver item V.2).
Quarta linha: Biomarcadores realizados.
V.2. Tipo histológico, segundo a classificação mais recente da Organização Mundial da Saúde (OMS) para as neoplasias do SNC (Louis et al., 2016), com respectivo grau histológico usual e seu CID-O. Para algumas entidades o grau histológico não foi atribuído por ser tema controverso na literatura. As entidades em negrito representam as entidades mais frequentes na faixa etária pediátrica e adolescência. As entidades em itálico são provisórias e/ou seu diagnóstico deve ser utilizado com cautela.
V.2.1. Tumores oligodendrogliais e astrocíticos difusos
- Astrocitoma difuso, sem outra especificação (grau II) – 9400/3
- Astrocitoma difuso, IDH-mutante (grau II) – 9400/3
- Astrocitoma difuso, IDH-selvagem (grau II) – 9400/3
- Astrocitoma gemistocítico, IDH-mutante (grau II) – 9411/3
- Astrocitoma anaplásico, sem outra especificação (grau III) – 9401/3
- Astrocitoma anaplásico, IDH-mutante (grau III) – 9401/3
- Astrocitoma anaplásico, IDH-selvagem (grau III) – 9401/3
- Glioblastoma, sem outra especificação (grau IV) – 9440/3
- Glioblastoma, IDH-mutante (grau IV) – 9445/3
- Glioblastoma, IDH-selvagem (grau IV) – 9440/3
- Glioblastoma epitelioide (grau IV) – 9440/3
- Glioblastoma de células gigantes (grau IV) – 9441/3
- Gliossarcoma (grau IV) – 9442/3
- Glioma difuso da linha média, H3 K27M-mutante (grau IV) – 9385/3
- Oligodendroglioma, sem outra especificação (grau II) – 9450/3
- Oligodendroglioma, IDH-mutante e 1p/19q-codeletado (grau II) – 9450/3
- Oligodendroglioma anaplásico, sem outra especificação (grau III) – 9451/3
- Oligodendroglioma anaplásico, IDH-mutante e 1p/19q-codeletado (grau III) – 9451/3
- Oligoastrocitoma, sem outra especificação (grau II) – 9382/3
- Oligoastrocitoma anaplásico, sem outra especificação (grau III) – 9382/3
V.2.2. Outros tumores astrocíticos
- Astrocitoma pilocítico (grau I) – 9421/1
- Astrocitoma pilomixoide (grau I ou II) – 9425/3
- Astrocitoma subependimário de células gigantes (grau I) – 9384/1
- Xantoastrocitoma pleomórfico (grau II) – 9424/3
- Xantoastrocitoma pleomórfico anaplásico (grau III) – 9424/3
V.2.3. Tumores ependimários
- Subependimoma (grau I) – 9383/1
- Ependimoma mixopapilar (grau I) – 9394/1
- Ependimoma (grau II) – 9391/3
- Ependimoma de células claras (grau II) – 9391/3
- Ependimoma papilar (grau II) – 9393/3
- Ependimoma tanicítico (grau II) – 9391/3
- Ependimoma, fusão de RELA-positivo (grau II ou III) – 9396/3
- Ependimoma anaplásico (grau III) – 9392/3
V.2.4. Outros gliomas
- Glioma cordoide do terceiro ventrículo (grau II) – 9444/1
- Glioma angiocêntrico (grau I) – 9431/1
- Astroblastoma – 9430/3
V.2.5. Tumores do plexo coroide
- Papiloma do plexo coroide (grau I) – 9390/0
- Papiloma do plexo coroide atípico (grau II) – 9390/1
- Carcinoma do plexo coroide (grau III) – 9390/3
V.2.6. Tumores neuronais e glioneuronais
- Tumor neuroepitelial disembrioplásico (grau I) – 9413/0
- Gangliocitoma (grau I) – 9492/0
- Ganglioglioma (grau I) – 9505/1
- Ganglioglioma anaplásico (grau III) – 9505/3
- Gangliocitoma displásico cerebelar (Doença de Lhermitte–Duclos) (grau I) – 9493/0
- Astrocitoma e Ganglioglioma desmoplásico infantil (grau I) – 9412/1
- Tumor glioneuronal papilar (grau I) – 9509/1
- Tumor glioneuronal formador de rosetas (grau I) – 9509/1
- Tumor glioneuronal leptomeníngeo difuso
- Neurocitoma central (grau II) – 9506/1
- Neurocitoma extraventricular (grau II) – 9506/1
- Liponeurocitoma cerebelar (grau II) – 9506/1
- Paraganglioma (grau I) – 8693/1
V.2.7. Tumores da região da pineal
- Pineocitoma (grau I) – 9361/1
- Tumor do parênquima pineal de diferenciação intermediária (grau II ou III) – 9362/3
- Pineoblastoma (grau IV) – 9362/3
- Tumor papilar da região da pineal (grau II ou III) – 9395/3
V.2.8. Tumores embrionários (todos grau IV)
- Meduloblastoma, sem outra especificação – 9470/3
- Meduloblastoma, clássico – 9470/3
- Meduloblastoma, desmoplásico/nodular – 9471/3
- Meduloblastoma com extensa nodularidade – 9471/3
- Meduloblastoma, de grandes células/anaplásico – 9474/3
- Meduloblastoma, WNT-ativado – 9475/3
- Meduloblastoma, SHH-ativado e TP53-mutante – 9476/3
- Meduloblastoma, SHH-ativado e TP53-selvagem – 9471/3
- Meduloblastoma, não-WNT/não-SHH – 9477/3
- Meduloblastoma, não-WNT/não-SHH: Meduloblastoma, grupo 3
- Meduloblastoma, não-WNT/não-SHH: Meduloblastoma, grupo 4
- Tumor teratoide/rabdoide atípico – 9508/3
- Tumor embrionário com rosetas em multicamada, sem outra especificação – 9478/3
- Tumor embrionário com rosetas em multicamada, C19MC-alterado – 9478/3
- Meduloepitelioma – 9501/3
- Neuroblastoma do SNC – 9500/3
- Ganglioneuroblastoma do SNC – 9490/3
- Tumor embrionário do SNC, sem outra especificação – 9473/3
- Tumor embrionário do SNC com características rabdoides – 9508/3
V.2.9. Meningioma
- Meningioma (grau I) – 9530/0
- Meningioma angiomatoso (grau I) – 9534/0
- Meningioma fibroso (grau I) – 9532/0
- Meningioma rico em plasmócitos (grau I)
- Meningioma meningotelial (grau I) – 9531/0
- Meningioma metaplásico (grau I) – 9530/0
- Meningioma microcístico (grau I) – 9530/0
- Meningioma psamomatoso (grau I) – 9533/0
- Meningioma secretor (grau I) – 9530/0
- Meningioma transicional (grau I) – 9537/0
- Meningioma cordoide (grau II) – 9538/1
- Meningioma de células claras (grau II) – 9538/1
- Meningioma atípico (grau II) – 9539/1
- Meningioma papilar (grau III) – 9538/3
- Meningioma rabdoide (grau III) – 9538/3
- Meningioma anaplásico (maligno) (grau III) – 9530/3
V.2.10. Tumores mesenquimais, não meningoteliais
- Tumor fibroso solitário/hemangiopericitoma, grau I – 8815/0
- Tumor fibroso solitário/hemangiopericitoma, grau II – 8815/1
- Tumor fibroso solitário/hemangiopericitoma, grau III – 8815/3
- Hemangioblastoma (grau I) – 9161/1
- Hemangioma (grau I) – 9120/0
- Sarcoma de Ewing (grau IV) – 9364/3
V.2.11. Tumores melanocíticos
- Melanocitose meníngea – 8728/0
- Melanocitoma meníngeo – 8728/1
- Melanoma meníngeo – 8720/3
- Melanomatose meníngea – 8728/3
V.2.12. Tumores de células germinativas
- Germinoma – 9064/3
- Carcinoma embrionário – 9070/3
- Tumor do seio endodérmico – 9071/3
- Coriocarcinoma – 9100/3
- Teratoma maduro – 9080/0
- Teratoma imaturo – 9080/3
- Teratoma com malignização somática – 9084/3
- Tumor misto de células germinativas – 9085/3
V.2.13. Tumores da região selar (todos grau I)
- Craniofaringioma adamantinomatoso – 9351/1
- Craniofaringioma papilar – 9352/1
- Tumor de células granulares da região selar – 9585/0
- Pituicitoma – 9432/1
- Oncocitoma de células fusiformes – 8290/0
V.2.14. Tumores dos nervos cranianos e paraespinhais
- Schwannoma (grau I) – 9560/0
- Schwannoma celular (grau I) – 9560/0
- Schwannoma plexiforme (grau I) – 9560/0
- Schwannoma melanótico (grau I) – 9560/1
- Neurofibroma (grau I) – 9540/0
- Neurofibroma atípico (grau I) – 9540/0
- Neurofibroma plexiforme (grau I) – 9550/0
- Perineurioma (grau I) – 9571/0
- Tumor maligno da bainha do nervo periférico (grau II, III ou IV) – 9540/3
V.2.15. Neoplasias hematológicas
- Linfoma difuso de grandes células B, primário do SNC – 9680/3
- Linfoma difuso de grandes células B, sem outra especificação – 9680/3
- Linfoma difuso de grandes células B EBV-positivo, sem outra especificação – 9680/3
- Granulomatose linfomatoide – 9766/1
- Linfoma de grandes células B intravascular – 9712/3
- Linfoma anaplásico de grandes células, ALK-positivo – 9714/3
- Linfoma anaplásico de grandes células, ALK-negativo – 9702/3
- Linfoma MALT da dura-máter – 9699/3
- Outros linfomas de células B de baixo grau do SNC
- Outros linfomas de células T e T/NK do SNC
- Histiocitose de células de Langerhans – 9751/3
- Doença de Erdheim-Chester – 9750/1
- Doença de Rosai-Dorfman
- Xantogranuloma juvenil
- Sarcoma histiocítico – 9755/3
V.2.16. Metástases
- Tipo histológico:______________________________
- Sítio primário:________________________________
V.3. Aspectos microscópicos particulares
V.3.1. Tumores gliais e glioneuronais
V.3.1.1. Padrão de disseminação
- Subpial
- Subaracnoide
- Subependimário
V.3.1.2. Proliferação endotelial microvascular
- Presente
- Ausente
V.3.1.3. Necrose tumoral
- Presente
- Ausente
V.3.1.4. Atividade mitótica
- Presente
- Ausente
- Índice mitótico: _______em 10 campos de grande aumento
V.3.2 Tumores meningoteliais
V.3.2.1. Atividade mitótica
- 0 a 4 por 10 campos de grande aumento (grau I)
- 5 a 20 por 10 campos de grande aumento (grau II)
- Maior que 20 por 10 campos de grande aumento (grau III)
V.3.2.2. Invasão do parêquima do SNC
- Presente (grau II, pelo menos)
- Ausente
V.3.2.3. Hipercelularidade
- Presente
- Ausente
V.3.2.4. Nucléolos proeminentes
- Presentes
- Ausentes
V.3.2.5. Pequenas células com aumento da relação núcleo/citoplasmática
- Presentes
- Ausentes
V.3.2.6. Padrão de crescimento difuso (perda do padrão meningotelial)
- Presente
- Ausente
V.3.2.7. Focos de necrose espontânea (tumoral)
- Presente
- Ausente
Notas:
1) A necrose isquêmica pode ser decorrente de embolização pré-operatória e/ou de radioterapia, e não necessariamente é sinal de malignidade.
2) Na ausência de alta atividade mitótica e invasão do SNC, a presença de 3 dos 5 itens de V.3.2.3 a V.3.2.7 caracterizam o diagnóstico de Meningioma atípico (grau II).
3) A presença de invasão óssea isoladamente não é critério de malignidade em meningiomas.
- Biomarcadores diagnósticos e preditivos
VI.1. Imunohistoquímica (IHQ – serão descritos os marcadores e a sua aplicação mais comum, caso haja)
VI.1.1. IDH1 (R132H) (para gliomas difusos de adultos):
- Positivo
- Negativo
- Não realizado
VI.1.2. ATRX (para gliomas difusos de adultos):
- Expressão preservada
- Perda de expressão
- Não realizado
VI.1.3. Expressão de p53:
- Negativo – padrão não mutado
- Positivo – padrão mutado (positividade nuclear forte e difusa)
- Não realizado
VI.1.4. Índice proliferativo – Ki-67:
- ___% de núcleos positivos de células neoplásicas (em hot spot)
- Não realizado
VI.1.5. GFAP:
- Negativo
- Positivo
- Não realizado
VI.1.6. OLIG2:
- Negativo
- Positivo
- Não realizado
VI.1.7. Sinaptofisina:
- Negativo
- Positivo
- Não realizado
VI.1.8. Neurofilamento:
- Presença de axônios aprisionados na neoplasia
- Ausência de axônios aprisionados na neoplasia
- Não realizado
VI.1.9. Beta-catenina (para meduloblastoma):
- Negativo (ausência de expressão nuclear)
- Positivo (presença de expressão nuclear)
- Não realizado
VI.1.10. Histona H3 K27M (para gliomas difusos da linha média)
- Negativo
- Positivo
- Não realizado
VI.1.11. L1CAM (como marcador indireto da fusão RELA em Ependimoma supratentorial)
- Negativo
- Positivo
- Não realizado
VI.1.12. LIN28A (como marcador indireto de Tumores embrionários, C19MC-alterados)
- Negativo
- Positivo
- Não realizado
VI.1.13. INI-1 (para tumores embrionários)
- Perda de expressão
- Expressão preservada
- Não realizado
VI.1.14. STAT-6 (como marcador de Tumor fibroso solitário/hemangiopericitoma)
- Negativo
- Positivo
- Não realizado
VI.1.15. EMA (para tumores meníngeos)
- Negativo
- Positivo (especificar o padrão)
- Não realizado
VI.1.16. Receptor de progesterona (para meningiomas)
- Negativo
- Positivo
- Não realizado
VI.1.17. Outros:
- Especificar: ____________________________
VI.2. Testes moleculares
VI.2.1. Codeleção de 1p e 19q (especificar o método):
- Ausente
- Presente
- Inconclusivo
- Não realizada
VI.2.2. Status de IDH1 e IDH2 (especificar o método):
- Presença de mutação (especificar)
- Ausência de mutação
- Não realizado
VI.2.3. Status de BRAF (especificar o método):
- Presença da mutação BRAF V600E
- Presença de fusão de BRAF
- Ausência de alterações
- Não realizado
VI.2.4. Status da metilação do promotor do MGMT (especificar o método):
- Metilado
- Não metilado
- Outros: _________________
- Não realizado
VI.2.5. Status de EGFR (especificar o método):
- Amplificado
- Não amplificado
- Outros: _________________
- Não realizado
VI.2.6. Outros testes:
- Especificar: ____________________________
VII. Diagnóstico final (exemplos)
VII.1. Produto de lobectomia frontal esquerda:
Diagnóstico integrado: Glioblastoma, IDH-mutante (grau IV da OMS), com metilação do promotor do gene MGMT.
Diagnóstico histopatológico: Glioblastoma.
Graduação histopatológica: grau IV.
Biomarcadores realizados: IDH-positivo (IHQ), perda de expressão de ATRX (IHQ), positividade para p53 (IHQ) e MGMT metilado (PCR).
VII.2. Produto de exérese de tumoração temporal direita
Diagnóstico integrado: Oligodendroglioma, IDH-mutante e 1p/19q codeletado.
Diagnóstico histopatológico: Oligodendroglioma.
Graduação histopatológica: grau II.
Biomarcadores realizados: IDH-positivo (IHQ), expressão de ATRX preservada (IHQ), ausência de expressão de p53 (IHQ) e presença de codeleção de 1p e 19q (FISH).
VII.3. Produto de biópsias estereotáticas de lesão em lobo parietal esquerdo
Diagnóstico integrado: Astrocitoma difuso, sem outra especificação (SOE – grau II da OMS).
Diagnóstico histopatológico: Astrocitoma.
Graduação histopatológica: grau II.
Biomarcadores realizados: a designação SOE deve-se à não realização de biomarcadores neste caso.
VII.4 Produto de exame de ressecção tumoração frontal esquerda
Diagnóstico integrado: Oligodendroglioma, sem outra especificação (grau II da OMS).
Diagnóstico histopatológico: Oligodendroglioma.
Graduação histopatológica: grau II.
Biomarcadores realizados: IDH-positivo (IHQ), expressão de ATRX preservada (IHQ), ausência de expressão de p53 (IHQ). A designação SOE deve-se à não realização da pesquisa da codeleção de 1p e 19q neste caso.
VI.5 Produto de exame peroperatório de tumoração temporal direita
Consistente em meningioma com presença de mitoses. Grau histológico: aguardar cortes definitivos em tecido fixado.
VI.6 Produto de exame peroperatório de tumoração cerebelar
Glioma de baixo grau, compatível com astrocitoma pilocítico.*
* Nota: O diagnóstico de astrocitoma pilocítico no peroperatório é importante, pois o paciente poderá ser curado caso a exérese da neoplasia seja radical (remoção completa).
Observação: De forma similar, é importante obter o diagnóstico de germinoma no peroperatório, pois a cirurgia pode ser suspensa e o paciente ser adequadamente tratado por radioterapia e quimioterapia.
Nos exames peroperatórios:
- Até mesmo a informação de que a biópsia tenha atingido a lesão e que há material suficiente para o diagnóstico definitivo é mais informativa do que arriscar um diagnóstico.
2. Não realizar muitos esfregaços, pois pode-se consumir o tecido enviado – que poderá ser necessário para o diagnóstico definitivo.
VII. Comentários
VII.1 Em alguns casos, o seguinte texto pode ser acrescido ao final do laudo dos meningiomas: “Este laudo deve ser associado com a extensão da ressecção cirúrgica tumoral e demais dados clínicos e de imagens, para possível correlação com a evolução da lesão”. De forma similar, nas pequenas amostras: “a presente amostra pode não ser representativa da lesão como um todo”.
VII.2 Como as demais neoplasias, as primárias do SNC não possuem marcadores imunohistoquímicos específicos. No entanto, alguns painéis de anticorpos podem ser úteis, dependendo dos aspectos histopatológicos (Quadros 1 a 8).
Quadro 1 Painel imunohistoquímico no diagnóstico diferencial entre glioblastomas e oligodendrogliomas anaplásicos.
| Anticorpo | Glioblastoma | Oligodendroglioma Anaplásico |
| GFAP | ++/+++ | —* |
| Caveolina-1 | +++ | + |
| IDH1 | —/++** | +++ |
| Galectina-3 | +++*** | — |
* Exceto os oligodendrogliomas ricos em minigemistócitos, que podem ser GFAP+.
** Apenas a minoria dos glioblastomas (10 a 15%), os considerados secundários (oriundos da evolução de astrocitoma de menor grau), expressa IDH1.
*** Exceto GBM de pequenas células que geralmente não expressam Gal-3.
Nota: Olig2, um “marcador” de tumores oligodendrogliais, não é específico, podendo ser expresso em mais de dois terços dos astrocitomas difusos.
Quadro 2 Painel imunohistoquímico no diagnóstico diferencial entre glioblastomas e carcinomas metastáticos
| Anticorpo | Glioblastoma | Carcinoma metastático |
| GFAP | ++/+++ | —* |
| S100 | +++ | —/+** |
| CAM 5.2 (CK8/CK18) | — | +++ |
| Vimentina | +++ | —*** |
| Ber-ep4 | — | +++ |
| CEA | — | +++# |
* Tumores mistos e osteossarcomas podem expressar GFAP+.
** As neoplasias papilíferas da mama podem expressar S100, bem como os melanomas.
*** Exceto carcinomas do rim, mama, tireoide e endométrio.
# Principalmente nos adenocarcinomas.
Quadro 3 Painel imunohistoquímico no diagnóstico diferencial entre meduloblastoma e tumor rabdoide teratoide atípico (AT/RT).
| Anticorpo | Meduloblastoma | AT/RT |
| INI-1 (SNF5) | ++/+++ | — |
| CAM5.2 | — | ++/+++ |
| EMA | — | ++ |
| Actina, músculo liso | — | ++ |
Quadro 4 Painel imunohistoquímico no diagnóstico diferencial entre schwannomas e neurofibromas.
| Anticorpo | Schwannoma | Neurofibroma |
| S100 | +++ | ++ |
| Colágeno IV | ++ | — |
| Neurofilamento | — | +/++ |
Quadro 5 Painel imunohistoquímico no diagnóstico diferencial entre meningiomas e hemangiopericitomas.
| Anticorpo | Meningioma | Hemangiopericitoma/Tumor fibroso solitário |
| EMA | +++ | +/— |
| Colágeno IV | +/— | +++ |
| Alfa-1-antitripsina | +++/++ | — |
| Alfa-1-quimotripsina | +/++ | — |
| STAT-6 | – | + |
| ALDH1 | – | + |
| SSTR2A | + | – |
Quadro 6 Painel imunohistoquímico no diagnóstico diferencial entre carcinomas do plexo coroide e carcinomas metastáticos.
| Anticorpo | Carcinoma do plexo coroide | Carcinoma metastático |
| S100 | ++ | —* |
| GFAP | +/++ | — |
| Ber-ep4 | —/+ | ++/+++ |
| EMA | — | ++/+++ |
* Os carcinomas papilíferos da mama podem expressar S100.
Quadro 7 Painel imunohistoquímico para o diagnóstico diferencial entre cordomas e condrossarcomas.
| Anticorpo | Cordoma | Condrossarcoma |
| Brachyury | +++ | — |
| Podoplanina | — | ++/+++ |
| EMA | +++ | — |
| N-Caderina | ++/+++ | — |
| AE1/AE3 | +++ | — |
| CAM5.2 | ++/+++ | — |
Quadro 8 Painel imunohistoquímico para o diagnóstico diferencial entre hemangioblastoma e metástase de carcinoma renal.
| Anticorpo | Hemangioblastoma | Metástase de Carcinoma renal |
| PRP* | +++ | — |
| Brachyury | +++ | — |
| Inibina | ++/+++ | —/+ |
| PAX8 | — | ++/+++ |
| EMA | —/+ | +++/++ |
| CD10 | — | ++/+++ |
| RCC | — | ++/+++ |
* PRP: receptor de progesterona.
Nota: outro diagnóstico diferencial do hemangioblastoma pode ser o astrocitoma pilocítico (GFAP+).
VII.3 A imunoexpressão de GFAP pode ser focal ou mesmo ausente nos glioblastomas, que podem expressar pancitoceratinas (pan-CKs, AE1/AE3). Por essa razão, ao avaliar a expressão de citoceratinas em neoplasias no SNC, prefere-se utilizar CK8/CK18 (CAM5.2).
VII.4 No diagnóstico diferencial entre os astrocitomas e os ependimomas, a avaliação da expressão do EMA pode ser útil, posto que os ependimomas podem apresentar padrão dot.
VII.5 Nos tumores neuronais “puros” e mistos (glioneuronais, como gangliogliomas), sugere-se utilizar vários marcadores “neuronais”, como neurofilamento, sinaptofisina e Neu-N. Em geral, Neu-N apresenta maior expressão nos tumores com diferenciação neuronal mais avançada (neurônios maduros).
VII.6 O índice de proliferação celular avaliado pelo Ki-67 (IPC-Ki-67) tem se mostrado útil na diferenciação entre os tumores gliais difusos de baixo e alto graus, como entre os astrocitomas/oligodendrogliomas grau II versus grau III, principalmente em biópsias pequenas. Dessa forma, IPC-Ki-67 ≥ 3 a 5% favorece glioma difuso de maior grau de malignidade.
VII.7 A avaliação da imunoexpressão do IDH1 pode ser útil na diferenciação entre astrocitomas/oligodendrogliomas de baixo grau e gliose reacional, embora possam ser observados resultados falso-negativos (Camelo-Piragua et al., 2010).
VII.8 De forma similar, a avaliação da expressão da p53 pode ser útil na diferenciação entre gliomas e gliose ou processo reacional (Kurtkaya-Yapicier et al., 2002), embora o valor preditivo não seja absoluto.
VII.9 A deleção isolada ou combinada de 1p/19q é mais encontrada, porém não é exclusiva dos oligodendrogliomas, sendo pesquisada por hibridização in situ fluorogênica ou cromogênica (Fish e CISH, respectivamente) em tecido parafinado. Nos oligodendrogliomas em crianças, a deleção 1p/19q é um evento raro.
VII.10 Na avaliação molecular dos gliomas difusos, tem se preferido sistematizar as técnicas para tecido fixado em formalina e integrar com os achados de imuno-histoquímica para material emblocado em parafina (Figura 3).
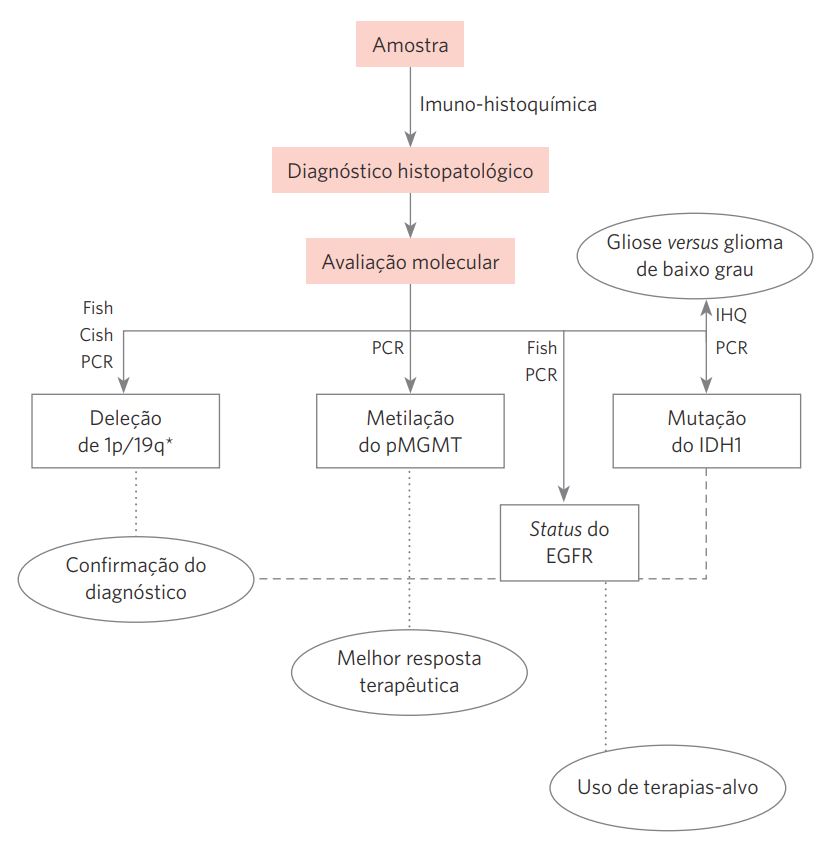
Figura 3 A avaliação dos gliomas difusos na era da patologia molecular tem como
objetivos, além da confirmação diagnóstica, a predição da resposta terapêutica e o
delineamento de terapias individualizadas (“teranóstica”).
FISH: hibridização in situ por fluorescência; CISH: hibridização in situ cromogênica; PCR: reação em cadeia de polimerase; IHQ: imunohistoquímica; pMGMT: promotor do gene codificador da enzima metiltransferase de DNA 06-metilguanina; EGFR: receptor do fator de crescimento epidérmico; IDH1: gene da enzima isocitrato deidrogenase 1.
*É importante observar que a deleção isolada ou combinada de 1p/19q é mais comumente encontrada, porém não é exclusiva dos oligodendrogliomas.
Fonte: adaptada de Jansen et al., 2010.
VIII. Considerações gerais
VIII.1 Na elaboração do diagnóstico final, sugere-se acrescentar o código Classificação Internacional das Doenças para Oncologia (CID-O) após a designação da neoplasia de acordo com a nomenclatura da classificação da OMS para os tumores do SNC (Louis et al., 2016), como pode ser visto no item V.2.
VIII.2 Nem sempre é possível realizar um diagnóstico específico somente com base nos aspectos morfológicos, às vezes mesmo com os achados imuno-histoquímicos. Nestes casos, termos gerais da categoria aparente da neoplasia podem ser empregados, juntamente com o provável grau. Exemplos de termos gerais são “Glioma de baixo/alto grau”, “Neoplasia glial de baixo/alto grau”, “Tumor glioneuronal de baixo/alto grau” e “Tumor neuroepitelial de baixo/alto grau”. Recomenda-se que os possíveis diferenciais sejam descritos em uma nota ou comentário, orientando quais exames complementares podem ser realizados para auxiliar a dirimir a dúvida diagnóstica.
Bibliografia
Brat DJ, Aldape K, Colman H et al. cIMPACT-NOW update 3: recommended diagnostic criteria for “Diffuse astrocytic glioma, IDH-wildtype, with molecular features of Glioblastoma, WHO grade IV”. Acta Neuropathol 2018; 136:805-810.
Burger P, Scheithauer BW. Diagnostic pathology: neuropathology. Philadelphia: Lippincott Williams & Wilkins, 2012.
Camelo-Piragua S, Jansen M, Ganguly A, Kim JC, Louis DN, Nutt CL. Mutant IDH1-specific immunohistochemistry distinguishes diffuse astrocytoma from astrocytosis. Acta Neuropathol 2010; 119(4):509-11.
Chen WC, Magill ST, Wu A, Vasudevan HN, Morin O, Aghi MK, Theodosopoulos PV, Perry A, McDermott MW, Sneed PK, Braunstein SE, Raleigh DR. Histopathological features predictive of local control of atypical meningioma after surgery and adjuvant radiotherapy. J. Neurosurg. 2018; 130(2):443-450.
Ellison D, Love S, Chimelli L, Harding B, Lowe JS, Vinters HV et al. Neuropathology: a reference text of CNS pathology. 3. ed. St Louis: Mosb, 2013.
Love S, Louis D, Ellison DW. Greenfield’s neuropathology. 8. ed. London: Hodder Arnold, 2008.
Louis DN, Ohgaki H, Wiestler OD, Cavenee WK et al. WHO Classification of Tumours of the Central Nervous System. 4. ed. Lyon: IARC,2016.
Louis DN, Perry A, Reifenberger G et al. The 2016 World Health Organization of Tumors of The Central Nervous System: a summary. Acta Neuropathol 2016; 131:803-820.
Louis DN, Wesseling P, Brandner S et al. Data Sets for the Reporting of Tumors of the Central Nervous System. Arch Pathol Lab Med 2018; 0565:1-11.
Pajtler KW, Witt H, Sill M et al. Molecular Classification of Ependymal Tumors across All CNS Compartments, Histopathological Grades, and Age Groups. Cancer Cell 2015: 729-743.
Pisapia DJ. The Updated World Health Organization Glioma Classification. Cellular and Molecular Origins of Adult Infiltrating Gliomas.2017; 141:1633-1645.
Prayson RA. Neuropathology. 2. ed. Philadelphia: Elsevier/Saunders, 2012.
Reifenberger G, Wirssching H-G, Knobbe-Thomsen CB and Weller > Advances in the molecular genetics of gliomas – implications for classification and therapy. Nature Reviews www.nature.com/nrclinonc 2016; 204:1-19.
Zhao F, Ohgaki H, Xu L et al. Molecular subgroups of adult medulloblastoma: a long-term single-institution study. Neuro-Oncology 2016; 18(7):982-990.
Voltar para a página inicial do manual