Margarida Maria Fernandes da Silva Moraes e Giovana Bachega Badiale Biagi
Introdução
Novos dados da literatura suscitam a adequação deste manual com revisão dos dados importantes, que permitam a mais exata classificação das lesões, com o intuito de melhor atendimento às pacientes. São adicionadas as modificações da FIGO (última edição de 2018), da OMS (edição 2014) e alguns dados da Sociedade Europeia da Patologia. As modificações enfocam principalmente as neoplasia epiteliais, as mais frequentes nestas gônadas, tubas uterinas e peritônio, com indicadores que se associam a prognóstico e abordagens clínicas.
Informes clínicos relevantes
Os ovários são retirados isolados, como parte de histerectomias e em fragmentos. Podem estar ou não acompanhados das tubas uterinas. Todos os espécimes dessa natureza devem ser recebidos acompanhados de história clínica detalhada com dados de idade, paridade, história menstrual, histórico de doenças (principalmente de neoplasias) e tratamentos pregressos (como quimioterapia pré-operatória, que pode alterar o aspecto morfológico e dificultar a determinação precisa do subtipo histológico), além da história familiar de câncer de mama/ovário/corpo do útero/intestino (que pode indicar síndromes com câncer ginecológico hereditário e a realização de testes complementares, como a pesquisa de alterações dos genes BRCA 1/2). Resultados de exames anatomopatológicos e/ou citopatológicos prévios devem também estar obrigatoriamente inclusos no pedido de exame.
Tumores ovarianos no “sensu lato” são detectados essencialmente por exame clínico e de imagem, principalmente ultrassonográficos. Os dados assim obtidos a partir desses métodos de avaliação, bem como resultados da pesquisa de marcadores tumorais (CA 125, CEA, CA 19.9, inibina, beta-HCG, AFP) devem ser do conhecimento do patologista, pois auxiliam na interpretação de possíveis diagnósticos diferenciais, incluindo a possibilidade de lesões metastáticas, principalmente quando se faz necessária uma opinião durante o ato cirúrgico. Se o exame durante o ato cirúrgico não for uma emergência determinada por um achado inesperado, deve estar baseado em todos os dados pregressos que permitam ao patologista exercer sua capacidade diagnóstica da maneira mais adequada possível.
Informações a respeito de problemas operatórios que possam resultar em ruptura capsular e/ou extravasamento de conteúdo de tumores císticos durante a cirurgia também devem ser fornecidas, bem como detalhes de espécimes cirúrgicos obtidos a partir de múltiplos sítios.
Códigos de topografia
C56 Ovário
C48.1 Partes especificadas do peritônio (feminino)
C48.2 Peritônio, não especificado (feminino)
C48.8 Lesão invasiva dos tecidos moles do retroperitônio e do peritônio (feminino)
I. Identificação e resumo clínico
II. Dados clínicos relevantes
III. Procedimento cirúrgico
IV. Exame macroscópico
IV.1 Procedimento(s)
- Ooforectomia direita
- Ooforectomia esquerda
- Salpingo-ooforectomia direita
- Salpingo-ooforectomia esquerda
- Salpingo-ooforectomia bilateral
- Ooforectomia subtotal direita
- Ooforectomia subtotal esquerda
- Histerectomia subtotal
- Histerectomia total
- Omentectomia
- Linfadenectomia (especificar) ____________
- Biópsias peritoneais
- Apendicectomia
- Outro (especificar) _____________
- Não especificado
IV.2 Espécimes(s) recebido(s)
- Ovário direito
- Ovário esquerdo
- Tuba uterina direita
- Tuba uterina esquerda
- Útero
- Corpo uterino
- Colo uterino
- Omento
- Linfonodo(s) (especificar) ________________
- Peritônio
- Apêndice cecal
- Outro(s) (especificar) ________________
- Não especificado
- Não pode ser determinado
IV.3 Medidas do(s) espécime(s) ___ x ___ x ___ cm
IV.4 Integridade do espécime
Ovário direito
- Não aplicável
- Cápsula intacta
- Cápsula rota
- Fragmentado
- Outro (especificar) _______________
Ovário esquerdo
- Não aplicável
- Cápsula intacta
- Cápsula rota
- Fragmentado
- Outro (especificar) ______________
IV.5 Localização do tumor
- Ovário direito
- Ovário esquerdo
- Ovários bilaterais
- Não especificado
- Outra (especificar) _______________
IV.6 Envolvimento da superfície ovariana
- Presente
- Ausente
- Incerto/não pode ser determinado
IV.7 Tamanho do tumor
Ovário direito (se aplicável)
- Maior dimensão ___ cm
- Outras dimensões ___ x ___ cm
- Não pode ser determinado
Ovário esquerdo (se aplicável)
- Maior dimensão ___ cm
- Outras dimensões ___ x ___ cm
- Não pode ser determinado
Outro(s) órgão(s) ou estrutura(s) (especificar)
- Maior dimensão ___ cm
- Outras dimensões ___ x ___ cm
- Não pode ser determinado
IV.8 Características do tumor
- Descrever ________________
- Exame microscópico
V.1 Tipo histológico (neoplasias epiteliais não benignas)
- Tumor seroso borderline convencional (Tumor seroso proliferativo atípico)
- Tumor seroso borderline de padrão micropapilar
- Carcinoma seroso
- Tumor mucinosoborderline, tipo intestinal (Tumor mucinoso proliferativo atípico)
- Tumor mucinosoborderline, tipo endocervical-símile (tipo mulleriano ou seromucinoso)
- Carcinoma mucinoso
- Tumor endometrioideborderline
- Carcinoma endometrioide
- Tumor de células claras borderline
- Carcinoma de células claras
- Tumor de células transicionais borderline
- Carcinoma de células transicionais
- Tumor de Brenner, tipo maligno
- Tumor epitelial misto borderline (especificar tipos e porcentagens) ____________
- Carcinoma misto (especificar tipos e porcentagens)____________
- Carcinoma indiferenciado
- Carcinossarcoma (tumor mesodérmico misto maligno)
- Outro (especificar) _____________
V.2 Microinvasão
- Ausente
- Presente
- Unifocal
- Multifocal
V.3 Carcinoma intraepitelial
- Ausente
- Presente
V.4 Carcinoma microinvasivo
- Ausente
- Presente
- Unifocal
- Multifocal
- Medidas do(s) foco(s) ___ x ___ mm
V.5 Graduação histológica
V.5.1 Sistema binário
- Baixo grau
- Alto grau
- Não aplicável
V.5.2 Sistema Figo
- Grau 1
- Grau 2
- Grau 3
- Não aplicável
V.5.3 Sistema OMS
- GX – Não pode ser avaliado
- G1 – Bem diferenciado
- G2 – Moderadamente diferenciado
- G3 – Pouco diferenciado
- G4 – Indiferenciado
- Não aplicável
V.6 Padrão de invasão
- Expansivo
- Infiltrativo
V.7 Invasão linfovascular
- Não identificada
- Presente
- Indeterminada
V.8 Implantes
- Implantes não invasivos
- Ausentes
- Presentes (especificar sítios) ___________
Tipo
- Desmoplásicos
- Epiteliais
- Implantes invasivos
- Ausentes
- Presentes (especificar sítios) ____________
V.9 Extensão de envolvimento tumoral
Ovário direito
- Ausente
- Presente
- Não aplicável
- Ovário esquerdo
- Ausente
- Presente
- Não aplicável
- Tuba uterina direita
- Ausente
- Presente
- Não aplicável
- Tuba uterina esquerda
- Ausente
- Presente
- Não aplicável
- Omento
- Ausente
- Presente
- Não aplicável
- Útero
- Ausente
- Presente (especificar local)
- Não aplicável
- Peritônio
- Ausente
- Presente
- Não aplicável
- Outros órgãos/tecidos (especificar) _______________
V.10 Linfonodos regionais (Tabela 1)
- Não aplicável
- Não avaliáveis
- Ausência de envolvimento tumoral ou metástases em ___ de ___ linfonodos dissecados ( ____/____ )
- Envolvimento tumoral por tumor borderline em ___ de ___ linfonodos dissecados ( ____/____ )
- Metástase de ____ em ____ de ____ linfonodos dissecados ( ____/___ )
Tabela 1 Localização dos linfonodos regionais.
| Local | Ausência | Com tumor | ||
| Direito | Esquerdo | Direito | Esquerdo | |
| Obturador | _____/_____ | _____/_____ | ||
| Ilíaco externo | _____/_____ | _____/_____ | ||
| Ilíaco interno | _____/_____ | _____/_____ | ||
| Ilíaco comum | _____/_____ | _____/_____ | ||
| Para-aórtico | _____/_____ | _____/_____ | ||
| Inguinal | _____/_____ | _____/_____ | ||
| Pélvico, SOE | _____/_____ | _____/_____ | ||
| Retroperitoneal, SOE | _____/_____ | _____/_____ | ||
| Outro __________ | _____/_____ | _____/_____ |
V.11 Células neoplásicas em líquidos
- Lavado peritoneal
- Presentes
- Ausentes
- Ascite
- Presentes
- Ausentes
- Outros (especificar) ______________
V.12 Achados adicionais
- Não identificados
- Endometriose
- Ovariana
- Extraovariana
- Endossalpingiose
- Outros, especificar lesão(ões) e sítio(s) _______________
V.13 Estudos especiais
- Imuno-histoquímicos (especificar) _______________
- Outros (especificar) _______________
VI.Diagnóstico final
VI.1 Exemplo de diagnóstico final
Produto de salpingo-ooforectomia direita com linfadenectomia pélvica:
- Carcinoma seroso de alto grau do ovário, com comprometimento da superfície ovariana. Ausência de neoplasia na tuba uterina.
- Metástases em 2 de 10 linfonodos regionais (para-aórticos).
- Líquido ascítico positivo para células neoplásicas malignas.
- Estadiamento patológico: Figo IIIC.
- 2 Estadiamento (Figo e TNM) das neoplasias do ovário
VI.2.1 Tumor limitado aos ovários (um ou ambos)
- IA – Tumor limitado a um ovário; cápsula intacta; ausência de tumor na superfície ovariana. Ausência de células malignas em ascite ou lavado peritoneal
- IB – Tumor limitado a ambos os ovários; cápsula intacta; ausência de tumor na superfície ovariana. Ausência de células malignas em ascite ou lavado peritoneal
- IC: Tumor limitado a 1 ou ambos ovários ou tuba uterina, com as seguintes alterações:
- IC1: Dispersão cirúrgica
T1c1‐N0‐M0
- IC2: Cápsula rota antes da cirurgia ou tumor na superfície ovariana ou na superfície tubária
T1c2‐N0‐M0
- IC3: Células malignas na ascite ou no lavado peritoneal
T1c3‐N0‐M0
VI.2.2Estadio II: Tumor envolve 1 ou ambos os ovários ou as tubas uterinas com extensão pélvica (abaixo da cintura pélvica) ou câncer peritoneal
T2‐N0‐M0
- IIA: Extensão e/ou implantes no útero e/ou tubas uterinas e/ou ovários
T2a‐N0‐M0
- IIB: Extensão para outros tecidos intraperitoneais pélvicos
T2b‐N0‐M0
VI.2.3 Estadio III: Tumor envolve um ou ambos ovários ou tubas uterinas, ou câncer peritoneal, com disseminação confirmada histologicamente ou citologicamente para além do peritônio pélvico e/ou metástases para os linfonodos retroperitoneais
T1/T2‐N1‐M0
- IIIA1: Apenas linfonodos retroperitoneais positivos (confirmado histologicamente ou citologicamente):
- IIIA1(i) Metástases até 10 mm de dimensão máxima
- IIIA1(ii) Metástases com mais do que 10 mm de dimensão máxima
- IIIA2: Envolvimento peritoneal extrapélvico microscópico (acima da cintura pélvica) com ou sem linfonodo retroperitoneal positivo
T3a2‐N0/N1‐M0
- IIIB: Metástases peritoneais macroscópicas além da pelve até 2 cm de dimensão máxima, com ou sem metástases para linfonodos retroperitoneais
T3b‐N0/N1‐M0
- IIIC: Metástases peritoneais macroscópicas além da pelve com mais de 2 cm de dimensão máxima, com ou sem metástases para linfonodos retroperitoneais (inclui extensão do tumor para cápsula do fígado e baço, sem envolvimento do parênquima de outros órgãos).
T3c‐N0/N1‐M0
VI.2.4 Estadio IV: Metástases à distância excluindo metástases peritoneais
- Estadio IVA: Líquido pleural com citologia positiva
- Estadio IVB: Metástases parenquimais (incluindo fígado e baço) e metástases para órgãos extra-abdominais (incluindo linfonodos inguinais e linfonodos fora da cavidade abdominal)
Qualquer T, qualquer N, M1
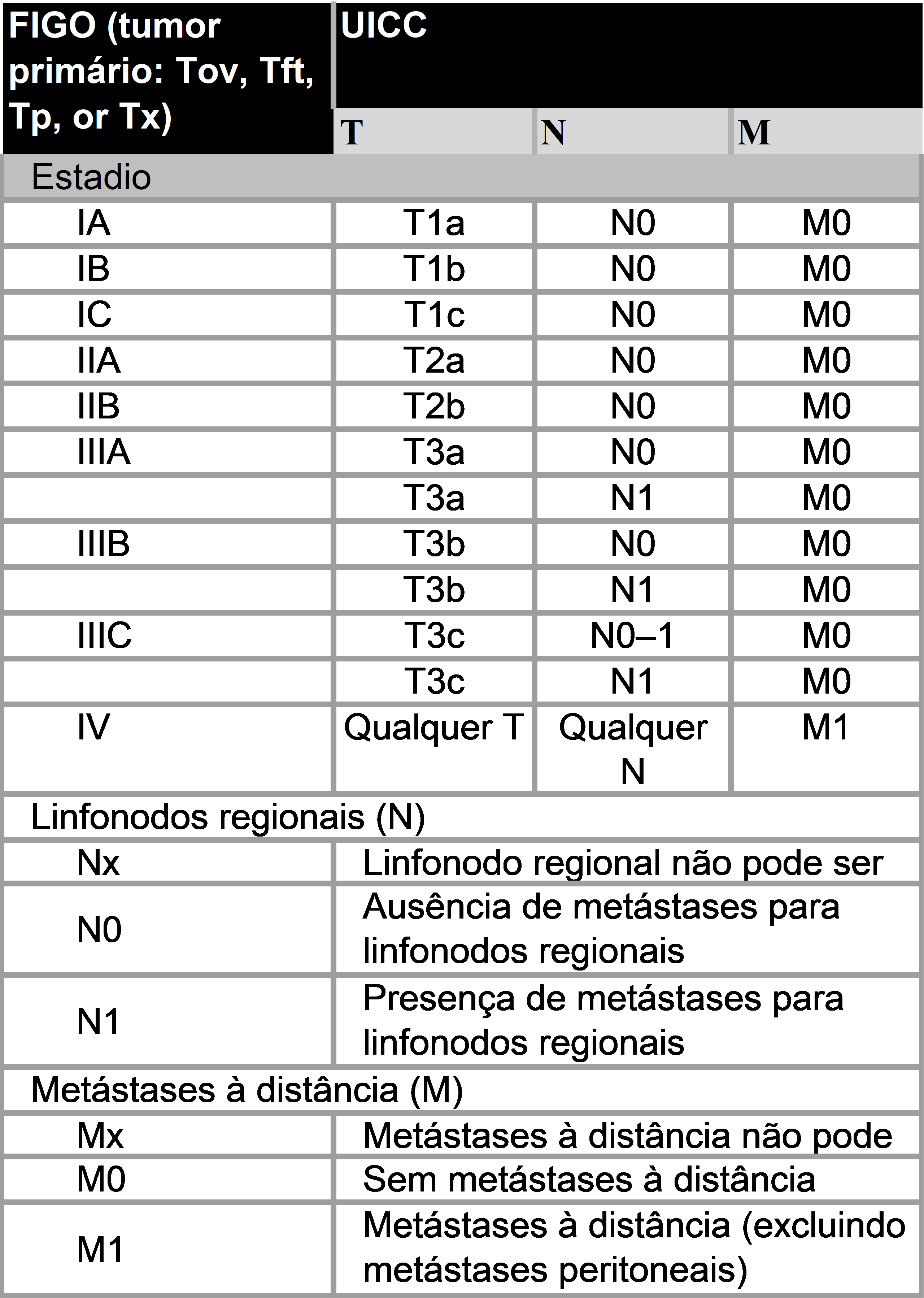
VI.3 TNM e Figo
Tabela 2-FIGO classificação de câncer de ovário, de tuba uterina e peritônio

* Nota: Linfonodos regionais: hipogástricos (obturatórios), ilíacos comuns, ilíacos externos, ilíacos internos, sacrais laterais, para-aórticos, inguinais.
VI.4 Agrupamentos para estadiamento
VI.4.1 Figo
Tabela 3 Câncer de ovário, tuba uterina e peritônio: FIGO (2014) comparado com TNM classificação.
VII. Comentários
VII.1 Exame macroscópico
VII.1.1 Ovários e tubas uterinas são retirados isoladamente ou acompanham a ressecção do útero. Fragmentos do ovário, em cunha, podem ser obtidos para avaliação de infertilidade ou para tratamento de pequenos tumores benignos.
VII.1.2 Tumores ovarianos podem vir acompanhados da respectiva tuba e também associados ao útero. Para estadiamento de neoplasias ovarianas, o procedimento pode incluir omento, múltiplas biópsias do peritônio e dissecção de linfonodos. No caso de tumores mucinosos, o apêndice pode também ser retirado. Em pacientes jovens com desejo reprodutivo, pode ser realizada apenas a salpingo-ooforectomia unilateral e omentectomia.
VII.1.3 Tumores ovarianos podem ser sólidos, císticos ou ambos. Devem ter registrados peso, dimensões (três dimensões que matematicamente definem os sólidos de formas irregulares) ou diâmetro(s), que define(m) formas esféricas regulares e estruturas ovais (dois diâmetros ou três). A presença da tuba e sua integridade também devem ser documentadas.
Notam-se os aspectos da superfície externa, se lisa, brilhante, irregular, com papilas, áreas de laceração, hemorragias, aderências a outras estruturas. Indicar se há tumor na superfície, nas aderências, nas zonas de ruptura e as dimensões. Em caso de suspeita de invasão da parede e de microrrupturas, a área deve ser marcada com tinta nanquim para posterior identificação microscópica. Cortes da cápsula, de áreas da cápsula com suspeita de solução de continuidade, locais de aderências e margens de ressecção (se houver) devem ser incluídos para análise em blocos especificamente identificados. Em casos de tumores heterogêneos, com áreas de aspecto benigno, borderline ou maligno, a determinação do sítio específico de ruptura pode ser importante. Define-se o aspecto da superfície de corte.
No caso de lesões sólidas, o padrão geral, se firme ou macio, com microcistos ou macrocistos (fornecer o diâmetro do menor e do maior), de aspecto variegado, com cores variadas do branco ao rosa ou hemorrágico. Se lesão cística, anotar o tipo de conteúdo: seroso ou mucoide, límpido ou sanguinolento. O cisto é unilocular ou multilocular? Há torção? Hemorragia? Necrose? Descrever o revestimento interno: se liso, lustroso, com papilas, fornecendo medidas em porcentagem ou em dimensões centimétricas das excrescências papilares, medindo sempre as placas maiores e menores, e se tais papilas são isoladas ou coalescentes. Avaliar paredes em sua espessura, textura, eventual invasão por tecido neoplásico, presença de cistos.
Depois da descrição macroscópica, reservar alguns cortes para congelação (se houver suspeita de tumor de células esteroides, quando as colorações para gordura podem ser indicadas). A seguir, fixar o espécime em formalina tamponada a 10%. Se a lesão for cística, pode ser colocada vazia no fixador e/ou secções da parede podem ser enroladas (como as membranas placentárias) e recortadas depois de fixadas, o que permitirá maior apreciação das condições do epitélio da superfície interna. Se a lesão for sólida, ela deve ser recortada e as fatias de cerca de 1 cm de espessura fixadas para recorte posterior.
A regra geral de amostragem é de 1 corte por cm da maior dimensão do tumor. É clássico em estudo de lesões ovarianas submeter 1 corte por 1 a 2 cm do tumor, medido em sua maior dimensão. Indica-se uma secção por centímetro em relação ao maior eixo do tumor, se a lesão tiver menos do que 10 cm. Se a lesão tiver mais do que 10 cm, pode-se submeter dois cortes por centímetro, ao longo do maior eixo. Em algumas situações, o mais útil será submeter uma fatia inteira ao longo do eixo maior.Outra possibilidade é a de selecionar áreas de padrão variado e amostrar todas essas
áreas para estudo histológico.
Em casos de tumores obviamente malignos e homogêneos à macroscopia ou de lesões volumosas císticas uniloculares de paredes finas, a amostragem pode ser menos extensa do que um corte por centímetro da maior dimensão tumoral. Por outro lado, se o tumor possuir diferentes aspectos à superfície de corte ou à abertura dos cistos, a amostragem pode ser mais extensa do que um corte por centímetro, a fim de se analisar histologicamente todas as diferentes áreas.
Deve-se incluir a zona de junção entre o ovário e a trompa adjacente, cortes para avaliar a relação do tumor com a tuba e também o tecido ovariano residual junto ao tumor, se houver.
Ovários inteiros, com ou sem tuba anexa, frequentemente chegam ao patologista para avaliação diagnóstica durante o ato cirúrgico, por causa da suspeita de tumores. Lesões ovarianas de origem tumoral podem ser adequadamente estudadas durante o ato cirúrgico por imprints de raspados da superfície e/ou por cortes histológicos por exames de congelação. Na maior parte dos casos, apesar da amostragem limitada, é possível orientar o tratamento cirúrgico. No propósito de avaliação imediata, é fundamental a boa avaliação macroscópica da lesão. O material recebido a fresco permite o estudo da lesão por imprints.
A superfície do ovário deve ser delicadamente manipulada (evitando-se esfregá-la ou deixá-la secar) e deve ser cuidadosamente inspecionada para a detecção de lesões, pois o envolvimento tumoral da superfície ovariana em tumores restritos ao ovário possui implicações relacionadas ao estadiamento e, possivelmente, à terapêutica. Os cistos devem ser esvaziados e lavados com delicadeza para não haver deslocamento de eventuais crescimentos papilíferos. Os tumores sólidos devem ser seccionados com separação de fatia inteira de 0,5 a 1 cm de espessura para fixação ótima e recorte posterior. Em seguida, procede-se à fixação, que deve ser em formalina a 10%, na qual geralmente se usa volume de fixador correspondente a 10 vezes o volume da peça. Alguns fragmentos podem ser colocados em fixadores especiais para técnicas mais sofisticadas de avaliação (enzimas, hormônios, etc.) ou congelados.
VII.1.4 Tumores ovarianos mucinosos são geralmente volumosos e heterogêneos, e devem ser bem amostrados. Devem ser valorizadas áreas de aspecto sólido ou esponjoso, nas quais há maior probabilidade de se encontrar elemento borderline ou carcinomatoso (mas que também podem representar um conglomerado de cistos com secreção espessa, um componente fibromatoso, um tumor de Brenner ou teratoma associado ou ainda um nódulo mural, benigno ou maligno). No caso de tumores mucinosos císticos uniloculares de paredes finas volumosos, a amostragem pode ser menos extensa do que um corte por centímetro da maior dimensão tumoral. Já no caso de um tumor mucinoso predominantemente sólido, pode-se inicialmente obter um fragmento para cada 4 cm da maior dimensão do tumor e, se necessário, amostrar novamente a lesão com até um corte por centímetro de tumor sólido ou esponjoso, naqueles casos nos quais a amostragem adicional provavelmente vá impactar o diagnóstico.
Casos de tumores mucinososborderline com microinvasão, carcinoma intraepitelial (especialmente se este último for extenso e/ou multifocal), carcinoma microinvasivo ou invasão expansiva, assim como casos de tumores serosos borderline com microinvasão, carcinoma microinvasivo ou áreas de aspecto micropapilar possuem risco elevado de conter áreas de invasão estromal franca e devem ser amostrados extensamente com mais do que um corte por centímetro da maior dimensão do tumor. Teratomas sólidos e tumores germinativos malignos também devem ser amplamente amostrados. Em exame intraoperatório de congelação, se um tumor mucinoso possuir um componente sólido ou esponjoso significativo e os cortes de congelação obtidos da área mais sólida mostrarem morfologia benigna ou borderline, é prudente emitir um parecer provisório de “tumor mucinoso” e solicitar ao cirurgião que aguarde cortes adicionais do exame de parafina (com amostragem mais extensa, a partir da qual será obtido um diagnóstico mais preciso). O cirurgião deve ser alertado sobre a possibilidade de encontrar carcinoma no exame de parafina, a fim de que seja considerada a realização de procedimento de estadiamento, bem como deve ser informado sobre a possibilidade de se tratar de lesão metastática simulando tumor primário, principalmente se o tumor for bilateral e/ou houver Pseudomyxomaperitonei; em caso positivo, o apêndice deve ser retirado, e o estômago, os intestinos e o pâncreas devem ser examinados. Mais raramente, tumores mucinosos primários ovarianos originados em teratomas podem estar associados a Pseudomyxomaperitonei.
Quando o tumor envolve o ovário e a tuba uterina, pode ser impossível determinar o sítio primário da neoplasia. Mais frequentemente, o tumor é predominante no ovário e, pelos critérios atuais – nos quais se considera a massa dominante como critério principal na aferição do sítio primário –, o ovário é considerado sítio primário da neoplasia (ainda que, mais recentemente, a tuba uterina venha sendo cada vez mais implicada como fonte dos tumores epiteliais serosos – sobretudo carcinoma de alto grau – ovarianos, quando se considera a presença de lesões com morfologia de carcinoma intraepitelial na tuba uterina como critério principal na aferição da tuba como sítio primário da neoplasia e como fonte da massa tumoral dominante ovariana).
O ovário contralateral pode ser não dominante (conter tumor similar ao do ovário dominante, mas de dimensões menores), pode estar aparentemente envolvido por tumor metastático ou macroscopicamente normal. Implantes tumorais na superfície, múltiplos nódulos e invasão linfovascular hilar (esta última, pouco comum nos carcinomas primários de ovário) favorecem metástase.
Da mesma maneira, tumores com envolvimento predominante da superfície ovariana sem envolvimento do parênquima são mais provavelmente originados na tuba ou no peritônio. Se o tumor envolve ou está centrado principalmente no hilo ovariano, pode se tratar de metástase, como já referido, ou ainda de lesão primária originada naquela topografia.
Se a tuba apresentar tumor, fazer cortes representativos para avaliar a distribuição topográfica e a relação do tumor com o epitélio tubário.
Em pacientes submetidas a salpingo-ooforectomia profilática por mutações dos genes BRCA ou com suspeita de risco aumentada de câncer hereditário anexial/mamário, pequenos carcinomas na superfície ovariana, potencialmente letais, podem não ser detectados em razão de exame macroscópico subótimo. Nesses casos, todos os tecidos ovarianos e tubários devem ser seccionados seriadamente e incluídos para exame microscópico, mesmo que não haja alterações macroscópicas. O infundíbulo e a extremidade distal fimbriada (2 cm distais) devem ser amputados e seccionados longitudinalmente. O istmo e a ampola devem ser cortados transversalmente em intervalos de 2 a 3 mm (protocolo SEE-FIM – eccioninganextensivelyexaminingthe fimbria) (Figura 1).
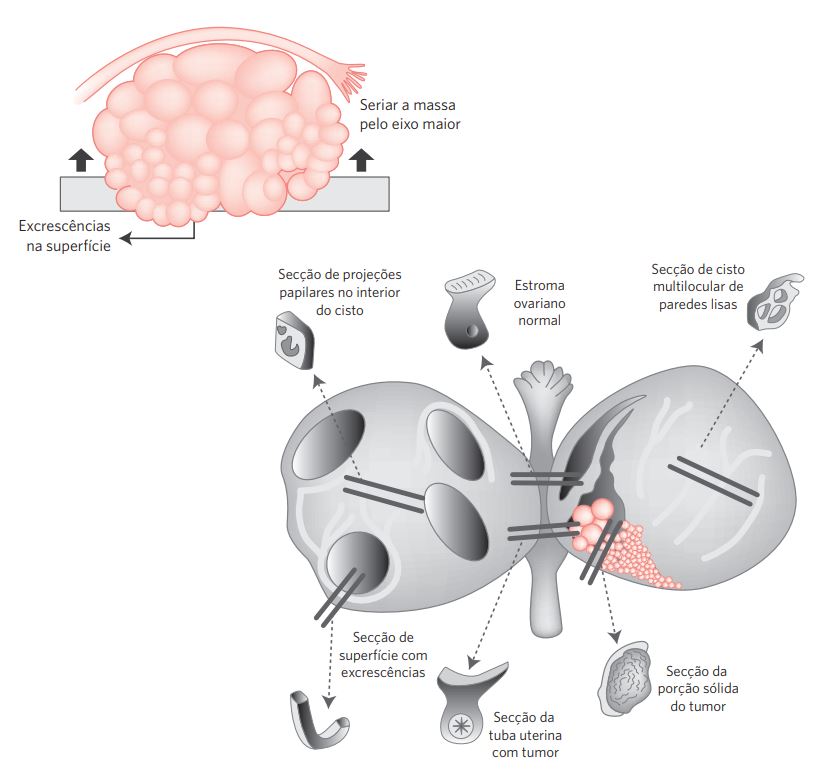
Figura 1 Salpingo-ooforectomia por tumor ovariano.
Se houver lesão tumoral na mucosa uterina, deve-se amostrá-la (conforme protocolo no capítulo 24 – Carcinomas do endométrio), documentando a ausência ou a presença e o padrão de acometimento miometrial ou outras lesões associadas, no intuito de se analisar a relação com a lesão tumoral ovariana (se são independentes ou metástases de um órgão para o outro). Na determinação da relação entre carcinomas endometrioides presentes em ovário(s) e útero (condição na qual existe possibilidade significativa de neoplasias sincrônicas independentes), é importante também a documentação da presença de endometriose e/ou de componente adenofibromatoso no tumor ovariano.
Já em carcinomas serosos de alto grau (bem como em carcinomas de células claras e carcinossarcomas) envolvendo múltiplos órgãos pélvicos (condição na qual é mais provável que se trate de uma única lesão primária gerando metástases para as outras topografias), é importante a avaliação detalhada do endométrio macroscopicamente não tumoral, com o intuito de se afastar lesão neoplásica primária endometrial com metástase para ovário.
Mediante omento com lesão(ões) tumoral(is) macroscópica(s), submeter cortes representativos da(s) lesão(ões). No caso de omentos (ou de tecidos de outras topografias) com implantes associados a tumores borderline ou a teratomas imaturos ovarianos, submeter múltiplos cortes para avaliação microscópica. Se for detectada a presença de implantes nas lâminas originais, recomenda-se realizar múltiplos novos cortes histológicos para afastar invasividade (no caso de implantes associados a tumores borderline) ou imaturidade histológica (no caso de implantes associados a teratomas imaturos), cuja presença possui conotação prognóstica e terapêutica. Na avaliação de omento macroscopicamente negativo, 5 a 10 secções devem ser submetidas à análise histológica, a fim de se detectar lesões microscópicas. Biópsias para estadiamento devem ser totalmente incluídas para exame histológico.
Para linfonodos com lesões macroscópicas, submeter cortes representativos. Linfonodos macroscopicamente negativos devem ser totalmente submetidos à análise histológica (idealmente um por cassete, a depender do tamanho). Os linfonodos menores do que 5 mm podem ser submetidos inteiros.
O apêndice cecal deve ser cuidadosamente avaliado para a presença de lesões em mucosa, serosa, parede e eventuais pontos de ruptura, em especial em casos de Pseudomyxomaperitonei, condição na qual deve ser totalmente incluído para análise microscópica quando macroscopicamente normal.
Tubas uterinas e ovários não tumorais: descrição adequada da tuba. Presença de fímbria ou não. Comprimento. Diâmetro maior e menor das áreas anatômicas correspondentes, ou seja, istmo, ampola e infundíbulo. Superfície externa. Condições da luz: patente, obliterada e sinais de laqueadura. Seccionar a cada 0,5 cm e incluir uma secção de cada região. Descrever a parede. O ovário deve ser pesado e medido em três dimensões. Descrever a superfície externa. Cortar ao longo do eixo maior e o hilo. Incluir um corte a cada 2 cm do ovário não tumoral (Figura 2).
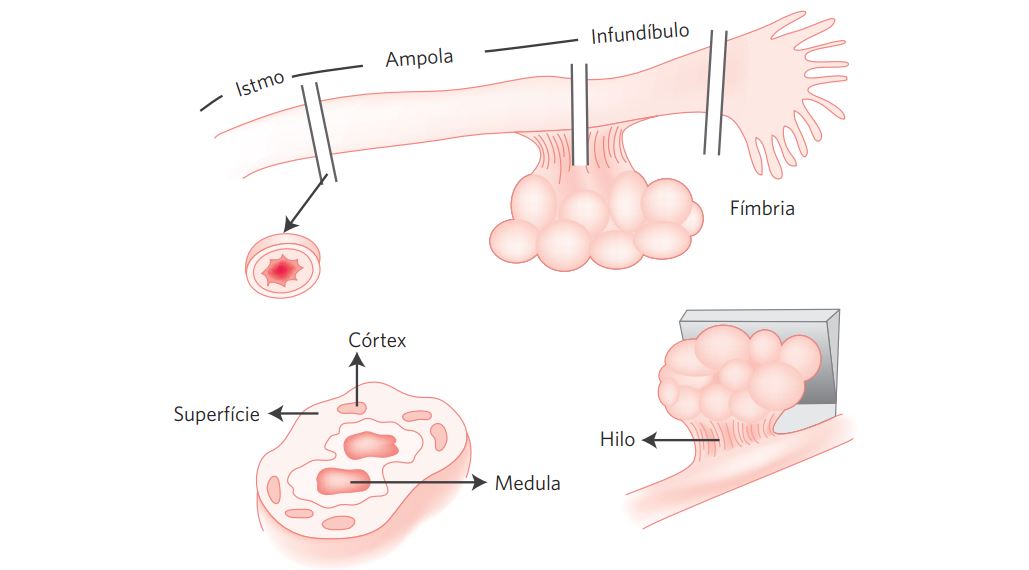
Figura 2 Anatomia da tuba uterina e do ovário.
VII.2 Laudo microscópico
As seguintes questões devem ser respondidas:
- Qual procedimento foi realizado? Quais órgãos ou estruturas estão presentes?
- Existe uma neoplasia?
- A cápsula está intacta ou rota? A neoplasia acomete a superfície ovariana?
- A neoplasia é epitelial? De tipo cordões sexuais/estroma? De células germinativas? Metastática?
- Em caso de tumor borderline: há microinvasão? Carcinoma intraepitelial? Carcinoma microinvasivo?
- O tumor envolve a tuba uterina adjacente ou o ligamento largo? Há envolvimento do ovário contralateral (se presente) e/ou de serosa tubária ou de paredes uterinas? O tumor acomete o omento? Há envolvimento de linfonodos?*
- As biópsias dos tecidos para estadiamento mostram metástases ou implantes? Eles são do tipo invasivo ou não invasivo?
- Em operações de tipo revisão ou second look: as aderências contêm neoplasia?
O laudo deve especificar os itens discutidos a seguir.
* Nota: Descrever o número de linfonodos com neoplasia e o número total de linfonodos examinados e especificar a localização.
VII.2.1 Em neoplasias epiteliais: tipo(s) de epitélio(s) presente(s)
Seroso, endometrioide, de células claras e mucinoso são os subtipos mais comuns de carcinoma primário de ovário. Apesar de a definição de tumores epiteliais mistos da OMS requerer que o segundo ou o terceiro componente represente mais de 10% do tumor, é recomendável que todos os diferentes subtipos morfológicos detectados sejam citados (mesmo que cada um individualmente não represente 10% do tumor), visto que mesmo a presença em quantidade mínima de um subtipo histológico mais agressivo pode ter implicação prognóstica desfavorável. Cabe aqui ressaltar que a descrição com quantificação dos diferentes componentes também pode ter implicação prognóstica e terapêutica em neoplasias não epiteliais, como em casos de tumores mistos germinativos malignos.
VII.2.2 Em neoplasias epiteliais: se o tumor é benigno, borderline ou maligno
VII.2.3 O grau de diferenciação
- Os carcinomas serosos do ovário (bem como os da tuba uterina e do peritônio) devem ser graduados em um sistema binário como de baixo ou alto grau. Essa distinção é baseada primariamente na avaliação de atipias nucleares na área em que o tumor tem a aparência mais atípica. Estudo recente demonstra que tal gradação binária é altamente reprodutível. No carcinoma seroso de baixo grau, os núcleos são uniformes com discreta atipia e com menos de 12 mitoses a cada 10 campos de grande aumento (o índice mitótico é de aproximadamente 2/10 campos de grande aumento). Não há necrose ou células gigantes multinucleadas. Os carcinomas serosos de alto grau mostram atipia nuclear de grau moderado a acentuado. Há mais de 12 mitoses a cada 10 campos de grande aumento. Necrose, células gigantes multinucleadas, bizarras, além de mitoses atípicas são frequentes. Carcinomas serosos de alto e baixo grau são doenças distintas.
- Carcinomas de células claras e carcinossarcomas são tumores de alto grau por definição (nestes últimos, é recomendável detalhar os componentes epitelial e mesenquimal, pois são informações que podem ter valor prognóstico).
- Carcinomas endometrioides devem ser graduados à maneira dos seus correspondentes uterinos, inclusive no que se refere a considerar a variante glandular de carcinoma seroso de alto grau em tumores com atipia citológica desproporcional ao grau arquitetural e extensa. Em tumores predominantemente sólidos, potencialmente diagnosticáveis como carcinomas endometrioides grau 3 (Figo), a possibilidade de carcinoma seroso de alto grau também deve ser afastada.
- Não há um sistema de graduação específico para carcinomas mucinosos. Recomenda-se que se utilize o mesmo sistema de graduação aplicado aos carcinomas endometrioides (p. ex., Figo).
VII.2.4 Graduação histológica de teratomas imaturos (e de seus implantes)
É realizada por meio da avaliação da quantidade de tecidos imaturos (embrionários). O elemento imaturo mais comumente presente e utilizado na graduação é o tecido neural imaturo (neuroepitélio). A diferença prognóstica e terapêutica mais importante é entre o grau I (baixo grau) e os graus II e III (alto grau). O diagnóstico de teratoma imaturo não é apropriado para casos ocasionais em que um ou poucos microfocos de tecido imaturo são detectados em teratomas císticos maduros típicos.
- Grau I – Raros focos de neuroepitélio (ocupando não mais do que um campo de pequeno aumento por/em qualquer lâmina).
- Grau II – O neuroepitélio ocupa mais do que 1 até 3 campos de pequeno aumento por/em qualquer lâmina.
- Grau III – Proeminente quantidade de neuroepitélio (4 ou mais campos de pequeno aumento por/em qualquer lâmina).
- Grau 0 (grau aplicado apenas a implantes tumorais) – Composto totalmente por tecidos maduros (geralmente tecido glial sem atividade mitótica).
VII.2.5 Graduação histológica de tumores de Sertoli-Leydig
Estes tumores são subdivididos em bem diferenciados, de diferenciação intermediária e pouco diferenciados, com base na forma e no grau de diferenciação tubular do componente de células de Sertoli (cuja quantidade – assim como ocorre com as células de Leydig – diminui com o aumento do grau da neoplasia) e na presença e na quantidade de estroma gonadal primitivo. Elementos heterólogos e/ou de padrão retiforme podem ser observados em todas as formas, exceto na bem diferenciada.
VII.2.6 Detectar se o tumor está confinado à substância do ovário ou se está presente na superfície ovariana
VII.2.7 Tecidos envolvidos por tumor (tubas uterinas, omento, peritônio ou outros)
- Tuba uterina: especificar o sítio de envolvimento tumoral (serosa ou mucosa).
- Omento: especificar o aspecto macroscópico e medir o tamanho do maior depósito tumoral (para fins de estadiamento). Deve ser realizada extensa amostragem do omento se, na avaliação microscópica inicial, forem detectados implantes não invasivos, a fim de se excluir a presença de implantes invasivos (indicadores de pior prognóstico e de possível tratamento quimioterápico complementar).
VII.2.8 Citologia de líquidos
Deve ser correlacionada (feita conjuntamente) com a avaliação histopatológica, pois, em uma avaliação isolada de uma amostra citológica, a presença de células epiteliais serosas em líquido peritoneal de paciente portadora de tumor seroso borderline pode gerar um diagnóstico errôneo de citologia “positiva para células neoplásicas malignas”. Incorporar o resultado do exame citopatológico ao laudo do exame histopatológico final.
Nota: As neoplasias de ovário epiteliais (principalmente as serosas) são frequentemente bilaterais. No caso de ambos os ovários estarem comprometidos, emitir laudo para cada um dos ovários seguindo o modelo fornecido. Acrescentar ao diagnóstico final os diagnósticos dos órgãos que frequentemente são ressecados em conjunto com os ovários neoplásicos.
VII.3 Tumores epiteliais – conceitos e definições
VII.3.1 Cistadenoma com atipia/proliferação focal
Tumor benigno com até 10% de área(s) com morfologia de padrão borderline. Em contrapartida, se qualquer área ou foco com morfologia de padrão borderline for encontrado no componente de superfície ovariana de um tumor seroso, é importante já classificar a neoplasia como tumor seroso borderline (em razão do potencial de comportamento mais agressivo com formação de implantes peritoneais).
VII.3.2 Tumor seroso borderline, variante micropapilar
Já é uma entidade reconhecida. Para tal diagnóstico, deve ser encontrada uma área de pelo menos 5 mm com características de tumor micropapilar (ou cribriforme) em um tumor seroso borderline convencional. O carcinoma seroso de baixo grau provavelmente se origina a partir de tumor seroso borderline de padrão micropapilar em sequência adenoma-carcinoma. São mais frequentemente bilaterais (no mínimo parcialmente), exofíticos e mais frequentemente associados a implantes peritoneais do que os tumores serosos borderline convencionais. Devem ser bem amostrados por causa também da maior probabilidade de conter focos de invasão estromal franca em comparação aos tumores serosos borderline convencionais.
VII.3.3 Implantes (apenas para tumores serosos ou seromucinososborderline)
A amostragem do tecido subjacente é crucial para avaliação de invasão.
VI.3.3.1 Implantes invasivos
- Podem macroscopicamente se apresentar sob a forma de pequenas massas estreladas.
- As glândulas são distribuídas desordenadamente, invadindo tecidos normais (principalmente o omento).
- Bordas irregulares.
- Reação fibrosa frouxa ou densa sem inflamação significativa.
- Proliferação epitelial geralmente dominante.
- Características nucleares de adenocarcinoma de baixo grau.
- Frequentemente associados a implantes não invasivos.
Nota: Um implante invasivo pode: (a) ser uma metástase de um tumor seroso borderline que contenha focos não amostrados (ocultos) de invasão; (b) representar o desenvolvimento de um carcinoma peritoneal primário independentemente do tumor seroso borderline a partir de foco de endossalpingiose; (c) ser resultado da proliferação de células neoplásicas implantadas em um microambiente mais permissível ao desenvolvimento de invasão estromal. É sinônimo de adenocarcinoma seroso de baixo grau. A maioria é encontrada no omento.
VII.3.3.2 Implantes não invasivos
- Extensão em septos fibrosos interlobulares do omento.
- Sem infiltração desordenada do tecido subjacente.
VII.3.3.2.1 Tipo desmoplásico
- A proliferação se apresenta macroscopicamente sob a forma de pequenas placas ou nódulos aderidos à superfície peritoneal.
- Dentro do omento, pode se apresentar sob a forma de finas traves esbranquiçadas de tecido fibroso representando septos expandidos entre lóbulos de gordura.
- Ninhos de células, glândulas e papilas proliferam em proeminente fundo de tecido fibroblástico ou de tecido de granulação denso (que tipicamente constitui mais de 50% ou a maioria da lesão), com margens bem definidas.
* Nota: Lesões “em placa” na superfície ovariana ou em septos por entre nódulos tumorais em tumores serosos borderline são denominadas autoimplantes e têm as mesmas características morfológicas dos implantes não invasivos do tipo desmoplásico.
VII.3.3.2.2 Tipo epitelial
- Pode aparecer como minúsculas lesões granulares.
- Preenche espaços submesoteliais.
- Proliferação com papilas ramificantes hierarquizadas, compostas predominantemente por células epiteliais
- Não há reação estromal.
- Presença de frequentes corpos psamomatosos.
VII.3.4 Microinvasão
Tumor ovariano epitelial com características borderline exibindo invasão inicial do estroma, caracterizado pela presença no estroma de células neoplásicas isoladas ou em pequenos grupos e com espaços claros ao redor, morfologicamente similares às células do componente não invasivo no que se refere ao grau de atipia nuclear, e com citoplasma amplo. Um ou mais focos podem estar presentes. Nenhum deve exceder 10 mm quadrados. Em artigos provenientes de eventos patrocinados, pelo NationalInstitutesof Health (NIH), alguns dados foram acrescentados sobre tumores borderline. Microinvasão: discussão sobre 3 ou 5 mm na maior dimensão (maior aceitação: 5 mm na maior dimensão). Lesões maiores do que 5 mm devem ser diagnosticadas como carcinomas (critérios mínimos: se há um diagnóstico de carcinoma, indicar o tamanho da área de invasão).
VII.3.5 Carcinoma microinvasivo
Origina-se em tumores borderline nos quais o componente não invasivo contém carcinoma intraepitelial (para tumores mucinosos, além de atipia acentuada associada a numerosas mitoses, alguns autores também consideram padrão intraglandularcribriforme e/ou crescimento intraglandular papilar sem estroma como critérios de carcinoma intraepitelial). Um ou mais focos podem estar presentes. Nenhum deve exceder 10 mm quadrados ou 5 mm na maior dimensão.
VII.4 Fatores e características morfológicas de valor prognóstico em neoplasias ovarianas epiteliais
VII.4.1 Tumores serosos borderline
- Estádio avançado ao diagnóstico: é o indicador prognóstico mais importante.
- Envolvimento da superfície ovariana: probabilidade marcadamente aumentada de disseminação extraovariana.
- Implantes extraovarianos (presentes em 20 a 40% dos casos): associados a risco significativo de recorrência e progressão para carcinoma invasivo. Implante invasivo é o indicador prognóstico mais importante em pacientes com doença em estádio avançado. Implantes não invasivos estão associados a cerca de 50% de recorrência (um terço dessas recorrências ocorrendo após 10 anos ou mais da ressecção do tumor primário) e a 25% de mortes por doença recorrente (na maioria das vezes, a doença recorrente é representada por carcinoma seroso de baixo grau) em estádios II e III.
- Arquitetura micropapilar: probabilidade aumentada de implantes extraovarianos (mesmo em tumores totalmente intracísticos; porém, na ausência de doença extraovariana, não tem significado prognóstico). Marcador de doença potencialmente mais agressiva e deve implicar avaliação detalhada de estádio e invasividade de implantes extraovarianos.
- Microinvasão: o padrão clássico (células isoladas, em pequenos grupos ou em papilas simples) não tem sido consistentemente demonstrado como indicador prognóstico adverso independentemente do estádio e da presença de implantes invasivos em tumores em estádio avançado. Já os padrões de microinvasão com micropapilas complexas, macropapilas invertidas e glândulas cribriformes menos comuns estão associados à maior probabilidade de lesão invasiva mais extensa e, portanto, a amostragem de tumores com esses padrões de microinvasão (considerados por alguns autores como tumores serosos borderline com carcinoma microinvasivo) deve ser extensa, no intuito de se excluir carcinoma seroso de baixo grau francamente invasivo.
- Envolvimento linfonodal: comum (cerca de 30% dos casos), geralmente associado à presença de implantes peritoneais e de endossalpingioselinfonodal (esta adjacente a ou aparentemente constituindo parte do depósito de tumor no linfonodo). Não possui associação significativa com prognóstico. A presença de agregados nodulares intralinfonodais de tumor medindo mais do que 1 mm (sem tecido linfoide de permeio, frequentemente associados a estroma desmoplásicoe a arquitetura micropapilar – que poderiam na realidade corresponder a adenocarcinoma seroso de baixo grau metastático) correlaciona-se a prognóstico adverso – característica esta, porém, não validada de maneira independente.
VII.4.2 Carcinomas (todos os subtipos)
Em doença avançada, o fator prognóstico mais importante é a presença ou não de doença residual depois do tratamento cirúrgico inicial. Mesmo pacientes em estádios avançados sem doença residual têm prognóstico consideravelmente melhor do que aquelas com doença residual mínima ou volumosa. Não é somente o tamanho da lesão residual que é importante, mas também o número de sítios de envolvimento por tumor residual (volume tumoral).
- O estádio é o principal fator prognóstico.
- Tipo histológico: para doença estádio I, os carcinomas endometrioides apresentam melhor sobrevida doença–específica em 10 anos (90%), em comparação aos carcinomas de células claras e mucinosos (70%) e aos carcinomas serosos (40%). Carcinomas de células claras, mucinosos e serosos de baixo grau não apresentam boa resposta à quimioterapia.
- Grau histológico: lesões bem diferenciadas têm prognóstico melhor do que as pouco diferenciadas, quando os estádios são comparáveis.
VII.4.3 Carcinomas serosos de alto grau
- O principal fator prognóstico em pacientes com neoplasias deste tipo (que frequentemente se apresentam em estádio avançado) é se o tumor foi completamente ressecado na primeira cirurgia, sem doença macroscópica residual.
- Linfócitos CD8-positivos intraepiteliais e perda de BRCA (câncer hereditário) estão associados a prognóstico favorável.
VII.4.4 Tumores endometrioides
- Borderline: tem excelente prognóstico (incluindo casos com microinvasãoou carcinoma intraepitelial).
- Carcinomas: possuem tendência a se apresentar em estádio inicial ao diagnóstico e menor frequência de ascite quando comparados a carcinomas serosos (mesmo em estádios mais avançados).
VII.4.5 Carcinomas de células claras
Têm taxas de sobrevida em 5 anos para doença em estádio I, intermediárias entre carcinomas serosos de alto grau (significativamente piores) e carcinomas endometrioides (significativamente melhores).
VII.4.6 Tumores mucinosos
- Borderline: são geralmente benignos. Apesar de dados de literatura escassos no que se refere a tumores com microinvasão e/ou carcinoma intraepitelial, o comportamento reportado também tem sido benigno em quase todos os casos. Relatos mais raros de estádio avançado e/ou morte por tumor podem estar relacionados a focos de invasão mais extensa não amostrados ou (mais provavelmente) a tumor metastático simulando tumor primário borderline, borderline com microinvasão, borderline com carcinoma intraepitelial ou mesmo microinvasivo. Metástases ovarianas também podem explicar recorrências em tumores diagnosticados como cistoadenomas de ovário.
- Carcinoma: o padrão de invasão do tipo expansivo/confluente tem se associado a melhor prognóstico quando comparado ao padrão de invasão do tipo infiltrativo. Cabe aqui ressaltar que este “pior prognóstico” associado ao padrão de invasão do tipo infiltrativo pode ser na realidade a lesão metastática em ovário simulando tumor primário, a qual mais comumente apresenta padrão de invasão infiltrativo. Vale também lembrar que o carcinoma mucinoso primário de ovário bilateral e/ou em estádio avançado é uma entidade rara, devendo ser afastada a possibilidade de metástases.
VII.5 Fatores e características morfológicas de valor prognóstico em algumas neoplasias ovarianas não epiteliais
- Tumores de células da granulosa: o estádio é o principal indicador prognóstico. Todos os tumores têm potencial de malignidade e podem desenvolver extensão extraovariana ou recorrências pélvicas/abdominais baixas. Em pacientes em estádio I (a maioria), idade mais jovem, tamanho maior do que 5 cm, atividade mitótica de mais do que 5 mitoses por cada 10 CGA, invasão linfovascular, ruptura tumoral e aneuploidia se associaram a pior prognóstico (em tumores do tipo adulto) em alguns estudos.
- Tecoma: raramente um tecomaluteinizado com atipias e atividade mitótica pode metastatizar. Pacientes com tecomasluteinizados associados à peritonite esclerosante podem evoluir com obstrução intestinal, que pode levar à morte, porém não têm sido relatadas recorrências ou metástases. A maioria dos tumores do tipo convencional e luteinizado é benigna, com raras exceções. Em virtude da associação com hiperplasia ou carcinoma endometrial, é indicada amostragem do endométrio.
- Fibromas celulares e fibromas celulares mitoticamente ativos: raramente fibromas celulares recorrem na pelve ou no abdome superior (ou porção superior do abdome), com frequência após longo intervalo, particularmente se havia aderências ou ruptura tumoral por ocasião do diagnóstico, condições nas quais o seguimento a longo prazo deve ser realizado.
- Tumores de Sertoli-Leydig: estádio, grau de diferenciação, ruptura tumoral, presença de componente retiforme ou elementos heterólogos. Tumores pobremente diferenciados, bem como tumores com elementos retiformes ou heterólogosmesenquimais, geralmente estão associados a um comportamento mais agressivo.
- Tumores dos cordões sexuais/estroma de tipo misto ou não classificados: os tumores de cordão sexual com túbulos anulares associados à síndrome de Peutz-Jeghers geralmente são benignos; 25% dos tumores não associados a essa síndrome têm comportamento maligno. Tumores de padrão infiltrativo e aqueles com 3 a 4 mitoses por cada 10 campos de grande aumento são agressivos. No entanto, é difícil a avaliação de casos individuais. Alguns tumores produzem hormônio antimülleriano e/ou alfa-inibina, e esses marcadores tumorais podem ser úteis para monitorar o curso da doença.
- Tumores de células esteroidais: pouco menos da metade dos tumores de células esteroidais é maligna. Estes em geral têm tamanho de 7 cm ou mais, atipia nuclear grau moderado a acentuado, 2 ou mais mitoses por 10 CGA, áreas de hemorragia e necrose. Ocasionalmente, à maneira de outras neoplasias endócrinas, o comportamento pode ser imprevisível, e tumores sem as características mencionadas podem ter um comportamento agressivo. Já o luteoma estromal e os tumores de células de Leydig são benignos.
- Struma ovarii (casos proliferantes): aderências, ascite (maior ou igual a 1 L) ou ruptura na serosa.
- Carcinoma em teratoma: a disseminação extraovariana está associada a pior prognóstico. Características favoráveis em tumores estádio I: melhor grau de diferenciação e ausência de invasão angiolinfática.
- Tumor dos seios endodérmicos: estádio III ou IV e tumores com citorreduçãosubótima estão associados a prognóstico menos favorável.
VII.6 Características associadas a metástases ovarianas
- Envolvimento bilateral.
- Tamanho relativamente pequeno (menor do que 13 cm).
- Padrão nodular de envolvimento, com variados padrões de crescimento dos nódulos.
- Padrão de invasão estromalinfiltrativo.
- Depósitos tumorais microscópicos na superfície.
- Invasão linfovascular proeminente (especialmente no hilo).
- Infiltração de células isoladas e células em anel de sinete.
- Células flutuando em mucina.
- Disseminação extraovariana.
- Nenhum desses aspectos é patognomônico de metástase. Carcinomas mucinosos metastáticos em ovário podem simular qualquer padrão citoarquitetural de neoplasia mucinosa primária (carcinoma, borderline e suas variantes, cistoadenoma). Algumas metástases, como de adenocarcinomas cervicais e colorretais, podem ser não incomumente unilaterais e volumosas.
VII.7 Lesões mucinosas peritoneais associadas a lesões ovarianas
VI.7.1 Pseudomyxoma peritonei
Por muitos anos esta síndrome (definida como a presença de ascite mucinosa, frequentemente volumosa e extensa, contendo um número variado de células epiteliais mucossecretoras) foi interpretada como manifestação secundária a disseminação peritoneal de tumor mucinoso borderline de tipo intestinal primário do ovário. Na última década, vários estudos indicaram que esta condição é mais comumente associada à ruptura de tumor mucinoso de baixo grau primário do apêndice cecal.
Pseudomixoma peritoneal ou Pseudomyxomaperitonei é essencialmente um termo clínico (e não um diagnóstico anatomopatológico), no qual podem ser utilizados os termos:
- Adenomucinose peritoneal disseminada: quando há predomínio de mucina, com quantidade escassa de epitélio, o qual exibe aspecto morfológico benigno, hiperplásico e/ou com atipia/displasia de baixo grau. Esta condição está mais tipicamente relacionada a lesões mucinosas císticas rotas de baixo grau do apêndice cecal (daí a possibilidade da utilização alternativa do termo neoplasia mucinosa de baixo grau do apêndice disseminada para estes casos). Não devem ser utilizadas as terminologias “tumor borderline” ou “tumor de baixo potencial de malignidade” (que poderiam remeter a lesões primárias ovarianas, excepcionais nestes casos). Do mesmo modo, a fim de se distinguir esta condição de variantes altamente proliferativas e agressivas, também é recomendável não utilizar a terminologia “carcinoma mucinoso” (bem diferenciado). Segundo alguns autores, apesar de se tratar de condição relativamente indolente, com baixas taxas de proliferação, ausência de invasão de tecido adiposo do omento, metástase linfonodal ou disseminação extra-abdominal, o uso da terminologia “carcinomatose mucinosa peritoneal de baixo grau” nestes casos poderia ser justificado pela morbimortalidade significativa associada à obstrução intestinal recorrente.
- Adenocarcinoma mucinoso metastático ou carcinomatose mucinosa peritoneal de alto grau: quando há quantidade importante de células epiteliais malignas, incluindo células em anel de sinete. Trata-se de uma condição clinicamente agressiva, com altas taxas de proliferação e pode derivar de qualquer carcinoma mucinoso.
VII.8 Critérios para o diagnóstico de carcinoma primário da tuba uterina (OMS)
- O tumor deve estar macroscopicamente localizado dentro da tuba ou em sua extremidade fimbriada.
- O útero e os ovários não devem conter carcinoma ou, se presente, este deve ser claramente diferente da lesão tubária:
- A presença de carcinoma intraepitelial na mucosa tubária adjacente ao carcinoma pode ser útil para auxiliar na confirmação do sítio primário tubário da neoplasia.
- A maioria dos carcinomas tubários é de tipo seroso ou endometrioide.
- A localização em extremidade fimbriada pode ter implicação prognóstica desfavorável (em comparação a tumores em outras topografias tubárias) por causa do acesso facilitado das células neoplásicas à cavidade peritoneal.
VII.9 Critérios para o diagnóstico de carcinoma primário do peritônio (GOG)
- Ambos os ovários devem ser normais em tamanho ou aumentados por processo benigno.
- O envolvimento em sítios extraovarianos deve ser mais extenso do que o envolvimento da superfície de qualquer um dos ovários.
O envolvimento tumoral ovariano deve ser inexistente, ou confinado ao epitélio de superfície sem invasão estromal ou envolver o estroma cortical com dimensões tumorais menores do que 5 x 5 mm:
- A maioria dos carcinomas primários do peritônio é do tipo seroso.
- Se há histórico de ooforectomia, o laudo deve ser revisto para confirmar ausência de carcinoma. Se a ooforectomia ocorreu nos últimos 5 anos, deve ser realizada revisão de lâminas para documentar ausência de carcinoma. Tumores primários do colo do útero, endométrio, ovários e tubas devem ser excluídos.
VII.10 Imuno-histoquímica
Deve ser sempre interpretada com base nos achados clínicos, intraoperatórios, macroscópicos e microscópicos. Na maioria dos casos, a análise cuidadosa dos dados morfológicos permite a distinção confiável entre tumores primários e metastáticos. Além disso, é importante ressaltar que a obtenção de cortes adicionais de tecido tumoral pode ser mais elucidativa do que a realização de exame imuno-histoquímico.
A seguir, serão apresentadas algumas informações sobre imuno-histoquímica em neoplasias ovarianas epiteliais (primárias e metastáticas) e germinativas.
VII.10.1 Imunofenótipos de carcinomas ovarianos (Tabela 4)
Observações:
- Tumores mucinosos de tipo mulleriano: positivos para CK7, CA125, RE e RP.
- CK7: carcinomas colorretais com fenótipo mucinoso frequentemente exibem positividade focal.
- CK20: a imunoexpressão costuma ser heterogênea nos tumores primários ovarianos, tendendo a ser mais difusa em áreas mais atípicas (borderline e carcinomatosas). Carcinomas colorretais com fenótipo mucinoso frequentemente exibem positividade difusa.
- CDX2: células de diferenciação escamosa morular em carcinomas endometrioides são comumente positivas.
- WT1: é mais frequentemente positivo em carcinomas serosos de origem tubo/ ovariana/peritoneal do que em carcinomas serosos primários do endométrio.
- TTF1: pode ser positivo em adenocarcinomas uterinos e ovarianos.
- P16: pode ser negativo em adenocarcinomas cervicais (do colo uterino) não relacionados a HPV.
- Betacatenina: muito mais frequentemente positiva (nuclear) em carcinomas mucinosos colorretais metastáticos do que em carcinomas mucinosos primários de ovário. Células de diferenciação escamosa morular em carcinomas endometrioides são comumente positivas.
- HNF1-beta: frequentemente positivo em carcinomas de células claras.
- PAX 8: carcinomas serosos (ou endometrioides) ovarianos são geralmente positivos; carcinomas de mama (que podem ser WT1 positivos) são geralmente negativos.
- DPC4: negativo em 50% dos adenocarcinomas ductais do pâncreas.
- CD10: positivo em carcinomas de células claras renais.
- P63, uroplaquina, trombomodulina, CK20: positivos em carcinomas transicionais urinários e negativos nos carcinomas ovarianos de padrão transicional. Positivos em tumores de Brenner (benignos e borderline; p63: negativo nos malignos).
Tabela 4 Imunofenótipos de carcinomas ovarianos (padrões mais comuns).
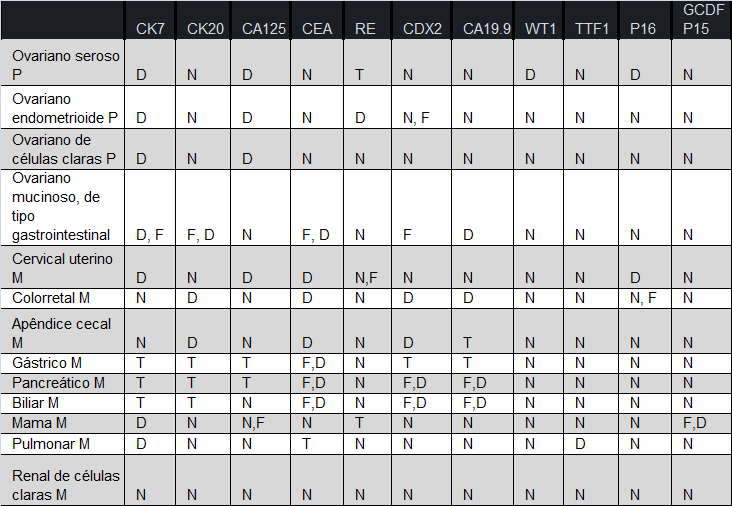
D: difuso; N: negativo; F: focal; T: todas as possibilidades; P: primário; M: metastático.
VII.10.2 Imunofenótipos de neoplasias germinativas ovarianas
Tabela 5 Imunofenótipos de neoplasias germinativas ovarianas (padrões mais comuns).
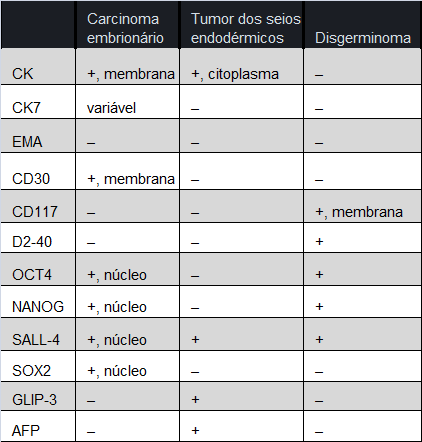
Notas:
AFP: muitos tumores dos seios endodérmicos são apenas focalmente positivos e alguns podem ser mesmo negativos.
PLAP: comumente positivo em disgerminoma e em tumor dos seios endodérmicos.
Beta-HCG: positivo citoplasmático em células sinciciotrofoblásticas de disgerminomas (e também em carcinomas com diferenciação trofoblástica).
OCT4 e glipican-3 (GLIP-3): podem ser positivos em carcinomas de células claras.
VII.11 Exames complementares em tumores de cordão sexual-estroma
- 11.1 Reticulina
- Rica e pericelular no tecoma.
- Pobre e alveolar nos tumores de células da granulosa.
- 11.2 Imuno-histoquímica
- CK7 e EMA: negativos.
- EMA pode ser positivo em tumor de células da granulosa juvenil.
- AE1/AE3: pode ser positivo em vários tumores de cordão sexual-estroma.
- Vimentina, inibina e calretinina: geralmente positivos.
- Inibina pode ser negativa (inclusive em tumores de células da granulosa do tipo adulto típicos) e também comumente em fibromas e tumores de Sertoli-Leydig pobremente diferenciados.
- Inibina e calretinina (fortemente) positivas em células luteinizadas não neoplásicas.
- WT1, melan–A, receptores hormonais, CD10, CD99, S100: podem ser positivos.
- WT1: útil na distinção de tumores endometrioides.
- CD56: forte sensibilidade.
- CD10: negativo em fibromas; positivo em tumor estromal microcístico positivo; a positividade é mais forte em sarcomas estromais endometrioides do que em tumores de cordão sexual-estroma (nestes últimos, geralmente é de baixa intensidade).
- Tumores de células esteroidais: HMB-45 e melan–A: positivos; MART-1: negativo.
VII.12 Classificação das neoplasias ovarianas, de tipo epitélio/estroma, segundo a última edição destas lesões pela OMS e pelos respectivos códigos internacionais de doenças
VII.12.1 Tumores serosos
Malignos
- Adenocarcinoma 8441/3
- Adenocarcinomapapilífero de superfície 8461/3
- Adenocarcinofibroma (adenofibroma maligno) 9014/3
- Borderline 8442/1
- Tumor cístico papilífero 8462/1
- Tumor papilífero de superfície 8463/1
- Adenofibroma, cistoadenofibroma 9014/1
Benignos
- Cistoadenoma 8441/0
- Cistoadenoma papilífero 8460/0
- Papiloma de superfície 8461/0
- Adenofibroma, cistoadenofibroma 9040/0
VII.12.2 Tumores mucinosos
Malignos
- Adenocarcinoma 8480/3
- Adenocarcinofibroma (adenofibroma maligno) 9015/3
- Borderline 8472/1
- Tipo intestinal
- Endocervical-símile
Benignos
- Cistoadenoma 8470/0
- Adenofibroma e cistoadenofibroma 9015/0
- Tumor cístico mucinoso com nódulos murais
- Tumor cístico mucinoso com Pseudomyxoma peritonei 8480/3
VII.12.3 Tumores endometrioides incluindo variantes com diferenciação escamosa
Malignos
- Adenocarcinoma, SOE 8380/3
- Adenocarcinofibroma (adenofibroma maligno) 8381/3
- Tumor mulleriano misto maligno (carcinossarcoma) 8950/3
- Adenossarcoma 8933/3
- Sarcoma estromalendometrioide (baixo grau) 8930/3
- Sarcoma indiferenciado ovariano 8805/3
Borderline
- Tumor cístico 8380/1
- Adenofibroma e cistoadenofibroma 8381/1
Benignos
- Cistoadenoma 8380/0
- Adenofibroma e cistoadenofibroma 8381/0
VII.12.4 Tumores de células claras
Malignos
- Adenocarcinoma 8310/3
- Adenocarcinofibroma (adenofibroma maligno 8313/3
Borderline
- Tumor cístico 8380/1
- Adenofibroma e cistoadenofibroma 8381/1
Benignos
- Cistoadenoma 8380/0
- Adenofibroma e cistoadenofibroma 8381/0
VII.12.5 Tumores de células transicionais
Malignos
- Carcinoma de células transicionais (tipo não Brenner) 8120/3
- Tumor de Brenner maligno 9000/3
Borderline
- Tumor de Brenner borderline 9001/1
- Variante proliferante 9001/1
Benignos
- Tumor de Brenner 9000/0
- Variante metaplásica 9000/0
VII.12.6 Tumores de células escamosas
- Carcinoma espinocelular 8070/3
- Cisto epidermoide 3341/0
VII.12.7 Tumores epiteliais mistos (especificar componentes)
Definidos como mistura de 2 ou mais elementos dos 5 tipos principais: seroso, mucinoso, endometrioide, de células claras e Brenner/transicional. O segundo e/ou terceiro tipos devem representar pelo menos 10% do tumor epitelial.
- Maligno 8323/3
- Borderline 8323/1
- Benigno 8323/0
VII.12.8 Tumores indiferenciados e não classificados
- Carcinoma indiferenciado 8020/3
- Adenocarcinoma, SOE 8140/3
VII.13 Classificação dos tumores de cordões sexuais-estroma (OMS)
VII.13.1 Tumores de células da granulosa-estromais
Grupo de tumores de células da granulosa
- Tipo adulto 8620/1
- Tipo juvenil 8622/1
Grupo tecoma-fibroma
- Tecoma, SOE 8600/0
- Típico 8600/0
- Luteinizado 8601/0
- Fibroma 8810/0
- Fibroma celular 8810/1
- Fibrossarcoma 8810/3
- Tumor estromal com componente mínimo de cordões sexuais 8593/1
- Tumor estromal esclerosante 8602/0
- Tumor estromal com células em anel de sinete
- Não classificado (fibrotecoma)
VII.13.2 Grupo de tumores de células de Sertoli–estromais
Grupo de tumor de células de Sertoli-Leydig
- Bem diferenciado 8631/0
- De diferenciação intermediária 8631/1
- Variante com elementos heterólogos 8634/1
- Pouco diferenciado (sarcomatoide) 8631/3
- Variante com elementos heterólogos 8634/3
- Retiforme 8633/1
- Variante com elementos heterólogos 8634/1
Tumor de células de Sertoli 8640/1
Tumor de células de Leydig-estromal
VII.13.3 Tumores de cordões sexuais-estroma mistos ou não classificados
Tumor de cordões sexuais com túbulos anulares 8623/1
- Variante associada com síndrome de Peutz-Jeghers
Ginandroblastoma 8632/1
Tumor de cordões sexuais-estroma, não classificado 8590/1
VII.13.4 Tumores de células esteroidais
- Luteoma estromal 8610/0
Grupo de tumores de células de Leydig
- Tumor de células hilares 8660/0
- Tumor de células de Leydig, tipo não hilar 8650/1
- Tumor de células de Leydig, SOE 8650/1
- Tumor de células esteroidais, SOE
- Bem diferenciado 8670/0
- Maligno 8670/3
VII.14 Tumores germinativos
- Disgerminoma 9060/3
- Tumor dos seios endodérmicos 9071/3
- Carcinoma embrionário 9070/3
- Coriocarcinoma 9100/3
- Poliembrioma 9072/3
- Teratoma imaturo (especificar grau) 9080/3
- Teratoma com transformação maligna 8070/3
- Tumor germinativo maligno misto (especificar componentes e porcentagens) 9085/3
- Teratoma maduro 9080/0
- Teratoma monodérmico (especificar tipo) __________________
VIII. Considerações gerais
Carcinomas serosos são os mais comuns no ovário e na tuba. Mais de 90% dos carcinomas tubários e ovarianos são serosos ou endometrioides de alto grau. Os carcinomas serosos podem ser classificados em alto grau e baixo grau, ajustando à sua biologia. Carcinomas serosos de alto grau têm alta frequência de mutações no TP53. Carcinomas serosos de baixo grau são frequentemente associados com tumores borderline e contêm mutações no BRAF e KRAS, com TP53 do tipo selvagem. A maioria dos Carcinomas serosos moderadamente diferenciados possuem mutações no TP53 e deve ser associado a tumores de alto grau.
Os dados da avaliação macroscópica e histológica cuidadosa, com informação sobre o tipo de neoplasia, sua exata classificação e extensão continuam representando o padrão ouro para orientação terapêutica.
A associação com os dados da patologia molecular e informações genéticas contribuem para orientar o tratamento, atualmente disponíveis, de algumas formas destas lesões e para fornecer dados para descobertas de futuros novos tratamentos
IV.Bibliografia
Baker P, Oliva E. Immunohistochemistry as a tool in the differential diagnosis of ovarian tumors. Inter J Gynecol Pathology 2004; 24:39-55.
Baker P, Oliva E. A practical approach to intraoperative consultation in gynecological pathology. Inter J Gynecol Pathology 2008; 27:353-65.
Cho KR.Ovarian cancer update: lessons from morphology, molecules, and mice.ArchPathol Lab Med. 2009 Nov;133(11):1775-81. doi: 10.1043/1543-2165-133.11.1775
College of American Pathologists (CAP). Protocol for the examination of specimens from patients with carcinoma of the ovary. 2012. Disponível em: https://www.cap.org/apps/docs/committees/cancer/cancer_protocols/2012/Ovary_12protocol.pdf; acessado em: 19 de setembro de 2013.
Domizio P, Lowe D. Oophorectomy for neoplasia. In: Reporting Histopathology Sections. London: Chapman & Hall Medical, 1997.
Edge SB, Byrd DR, Carducci MA, Compton CA (eds.). AJCC cancer staging handbook: from the AJCC Cancer Staging Manual. 7. ed. New York: Springer, 2010.
Hermanek P, Gospodarowicz, Henson DE, Hutter RVP, Sobin LH. Ovarian cancer. In: Prognostic factors in cancer. New York: Springer, 1995.
Hruban RH, Westra WH, Phelps TH, Isacson C. Ovary and fallopian tube. In: Surgical pathology pissection: an illustrated guide. 2. ed. New York: Springer, 2003.
Jonathan S. Berek Sean T. Kehoe Lalit Kumar Michael Friedlander; FIGO CANCER REPORT 2018 . Cancer of the ovary, fallopian tube, and peritoneum. 11 October 2018
Kurman RJ, Shih IEM. Pathogenesis of ovarian cancer: lessons from morphology and molecular biology and their clinical implications. Int J GynecolPathol 2008; 27:151-60.
Kurman RJ (ed.). Blaustein’s pathology of the female genital tract. 6. ed. New York: Springer, 2011.
Lester SC. Gynecological and perinatal pathology. In: Lester SC (ed.). Manual of surgical pathology. 3. ed. Philadelphia: Saunders, 2010.
TL R Duska E C Kohn. The new classifications of ovarian, fallopian tube, and primary peritoneal cancer and their clinical implications. Annals of Oncology, Volume 28, Issue suppl_8, November 2017, Pages viii8–viii12
McCluggage WG. My approach to and thoughts on the typing of ovarian carcinomas. J ClinPathol 2008; 61:152-63.
Reichert RA (ed.). Diagnostic gynecologic and obstetric pathology: an atlas and text. Philadelphia: WoltersKluwer Health/Lippincott Williams & Wilkins, 2012.
Robboy SJ, Anderson MC, Russell P (eds.). Robboy’s Pathology of the female reproductive tract. 2. ed. London: Churchill Livingstone, 2008.
Rosai J (ed.). Rosai and Ackerman’s surgical pathology. 9. ed. Saint Louis: Mosby, 2004.
Santin CA, Garrido AS, Feijó A, Alvarez MCR. Parâmetos histológicos predictivos em los tumores serosos limítrofes del ovário. Patologia Rev Latino-Am 2003; 41:129-39.
Scully RE, Young RH, Clement PB. Tumors of the ovary, maldeveloped gonads, fallopian tube and broad ligaments. In: Atlas of Tumor Pathology. Washington: AFIP, 1998.
Silverberg SG. Diagnostic problems in gynecologic pathology. California tumor tissue registry. 115 Semi-Annual Seminar December 7, 2003, San Francisco, CA.
Silverberg S. Borderline ovarian tumors: consensus, controversy, and continuing challenges. Pathol Case Rev 2006; 11:9-17.
Soslow RA (ed.). Current Concepts in gynecologic pathology: epithelial tumors of the gynecologic tract. Surgical pathology clinics. Philadelphia: Saunders, 2011.
Soslow RA, Tornos C (eds.). Diagnostic pathology of ovarian tumors. New York: Springer, 2011.
Tavassoli FA, Deville P (eds.). World Health Organization Classification of Tumors. Pathology and genetics: tumours of the breast and female genital organs. Lyon: IARC, 2003.
Wilkinson N, McCluggage WG. Standards and datasets for reporting cancers. Datasets for the histopathological reporting of neoplasms of the ovaries and fallopian tubes and primary carcinomas of the peritoneum. 3. ed. The Royal CollegeofPathologist, 2010.
Voltar para a página inicial do manual