Mariangela Esther Alencar Marques, Gilles Landman.
Códigos de topografia
C44- pele
C44.1 Pálpebra
C44.2 Ouvido externo
C44.3 Pele de outras partes e de partes não especificadas da face
C44.4 Pele da cabeça e do pescoço
C44.5 Pele do tronco
C44.6 Pele do ombro e membro superior
C44.7 Pele do quadril e membro inferior
C44.8 Lesão sobreposta da pele
C44.9 Pele, SOE (exclui pele da vulva C51.-, do pênis C60.9 e do escroto C63.2)
I. Identificação e resumo clínico
II. Dados clínicos relevantes
- Topografia_________
- Lateralidade________
- D
- E
- Linha media
- Não especificada
- Tempo de lesão________
- Alterações recentes________
III. Procedimento cirúrgico:
- Excisional
- “Shave/Saucerização
- Re- excisão
- Não especificado
Simples
Com estudo do linfonodo sentinela
- Uma base linfonodal (local)
- Mais de uma base linfonodal (locais)
Com esvaziamento linfonodal
- Exérese de metástase
- Outro (especificar)____________
IV.Exame macroscópico
IV.1 Tipo de fixador
- Formol tamponado 10%
- Formalina (não especificado)
- Sem fixação (fresco)
- Outro (especificar)________
IV.2 Medidas do espécime:
Maior diâmetro________mm
Menor diâmetro________mm
Espessura________mm
IV.3 Tamanho do tumor:
Diâmetro máximo________mm
Espessura________mm
- Não avaliável
IV.4 Distância da lesão à margem mais próxima _____ mm
- Não avaliável
IV.5 Descrição do tumor
- Assimetria
- Regressão
- Ulceração
- Bordas
- Coloração
IV.6 Satélite
- Presente
- Ausente
- Não avaliável
IV.7 Metástase em transito
- Presente
- Ausente
- Não avaliável
Nota 1 Satélite Macroscópica (SAT):Tumor macroscopicamente visível, distando ate 2cm do primário
Nota 2 Metástase em transito (MIT):Tumor clinicamente evidente, dérmico ou subcutâneo, distando mais de 2 cm do tumor primário.
IV.8 Linfonodo sentinela*
Tipo de fixador
- Formol tamponado 10%
- Formalina ( não especificado)
- Sem fixação(fresco)
- Outro (especificar)
Dimensões da peça________x________x________cm
Numero de linfonodos dissecados________
Medidas dos linfonodos
Maior________
Menor________
*Nota: Processamento macroscópico: deve ser processado em cortes seriados, com inclusão de todo o linfonodo (Neves et al. 2003). (Figura 1).
A presença de micrometástases pode ser definida pelo H.E. e/ou pela imunohistoquimica.
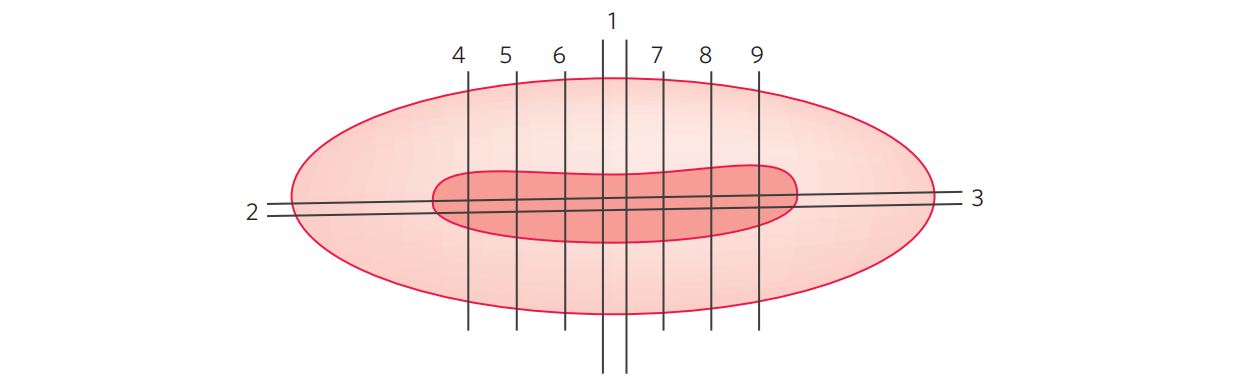
Figura 1 Processamento macroscópico do melanoma cutâneo.*Nota: Processamento macroscópico: Deve incluir toda a lesão macroscopicamente visível, iniciando (1) e terminando (9) com inclusão de pequena borda pele não comprometida nas laterais (permitirão avaliar os limites) além das margens laterais (10 e11).
IV.9 Exame microscópico
IV.1 Tipo Histológico
- Melanoma (SOE)
- Melanoma Extensivo Superficial
- Melanoma Nodular
- Lentigo Maligno Melanoma
- Melanoma Acral Lentiginoso
- Melanoma Desmoplásico/ Neurotrópico
- Melanoma de Nevo Azul
- Melanoma em nevo congênito gigante
- Melanoma da infância
- Melanoma spitzóide
- Melanoma nevóide
- Melanoma persistente
- Outro________(especificar)
- Ausência de melanoma residual
IV.10 Melanoma “in situ” Nivel I de Clark (para esses melanomas os demais dados utilizados para melanomas invasivos não se aplicam)
- Melanoma “ïn situ” (SOE)
- Melanoma “in situ” Extensivo Superficial
- Melanoma “in situ” do tipo Lentigo Maligno
- Melanoma Acral Lentiginoso “in situ”
- Melanoma ”in situ“ em nevo congênito gigante
- Melanoma persistente “in situ”
- Outro________(especificar)
*Nota: a presença de ulceração não afeta o prognostico do melanoma “in situ”
IV.11 Espessura Máxima (Breslow)*deve ser redigida com apenas uma casa decimal –aproximar para mais quando maior ou igual a 0,5 e para menos quando menor que 0,5.
- ________mm
- pelo menos________mm
- ________não avaliável
*Nota: A medida da espessura de Breslow pode ser difícil de avaliar na presença de infiltrado linfocitário ativo (brisk). Sugestão: utilizar imunohistoquimica igual a da rotina (sistema avidina biotina peroxidase- ABC) e marcadores de melanócitos (preferencialmente MelanA). No final da reação, substituir a contra coloração da Hematoxilina pela contra coloração com GIEMSA. Os melanócitos marcados em castanho poderão ser diferenciados de macrófagos com pigmento melânico que apresentarão coloração azul esverdeada. (Histopathology, 2007).
IV.12 Niveis de Clark
- Nivel I melanoma in situ
- Nivel II derme papilar, sem preencher ou expandir
- Nivel III derme papilar preenchida ou expandida
- Nivel IV derme reticular
- Nivel V subcutâneo
IV.13 Ulceração
- Presente
- Ausente
- Não avaliável
IV.14 Margens cirúrgicas laterais
- Livres
- Menor distancia da margem (especificar se possível)
- Comprometidas por:
- Melanoma in situ
- Melanoma invasivo
- Não avaliável
IV.15 Margem cirúrgica profunda
- Livre
- Distância do melanoma
- Comprometida por:
- Melanoma invasivo
- Não avaliável
IV.16 Índice mitótico*
- Zero mitoses identificadas________
- ≥1/mm2 = ________(numero de mitoses/mm2)
Nota: Índice mitótico deve ser calculado e referido no laudo de todos os melanomas primários invasivos:
Identificar a área na derme onde se encontra o maior número de figuras de mitose (“hot spot”). Utilizar o aumento 400X. Após contar as mitoses do “hot spot” estender a contagem pelos campos adjacentes até completar uma área de 1mm2. Se o hot spot não pode ser encontrado e as mitoses são esparsas, identificar uma mitose representativa em um campo e contar os demais campos adjacentes completando 1mm2. Para a maioria dos microscópios, aproximadamente 4 campos de 400X equivalem a 1mm2, porem a calibração adequada é recomendada. Calibração do microscópio: πR2 = 3,1416 x (diâmetro em mm do campo no aumento de 400x/2) 2 = área de um campo (AC).
IV.17 Satélite Microscópica (SAT)*
- Presente
- Não detectada
- Não avaliável
*Nota 1: Metástases cutâneas e ou subcutâneas microscópicas descontínuas do tumor primário, separados deste por tecido histologicamente normal, não fibrotico sem inflamação (sem sinais de regressão).
OBS-Antes de fazer o diagnostico de microsatelitose, recomenda-se cortes seriados do mesmo bloco para confirmação.
IV.18 Invasão angiolinfática
- Presente
- Não detectada
- Não avaliável
IV.19 Invasão perineural
- Presente
- Não detectada
- Não avaliável
IV.20 Infiltrado linfocitário (resposta hospedeiro)*
- Presente ativa (brisk)
- Presente inativa (non brisk)
- Ausente
*Nota: Considerar infiltrado ativo (brisk), o infiltrado linfocitário que envolve totalmente a base do tumor ou permeia e infiltra entre as células neoplásicas. Ver item 2: Espessura máxima (Breslow)
IV.21 Regressão
- Presente ≥ 75%
- Presente < 75%
- Ausente
- Não avaliável
IV.22 Fase de crescimento
- Radial
- Vertical
- Não avaliável
IV.23 Linfonodos
- Linfonodo Sentinela (LS)*
- Numero de LS examinados
- Linfonodos Regionais (LR)
- Numero de LR examinados
- Numero de LR com metástase
Extensão extranodal
- Presente
- Ausente
*Nota: Medida (em mm) do maior deposito metastático no linfonodo sentinela (LS) ou nos linfonodos regionais (LR).
IV.24 Metástase em transito (MIT)*
- Presente________
- Ausente________
- Não Avaliável________
* Nota: Metástases identificadas numa distancia maior que 2 cm do melanoma situadas entre o tumor e o primeiro local de linfonodos regionais.
IV.25 Estadiamento patológico
pTNM
- m- múltiplos
- r- recorrente
- y- pós tratamento
T – Tumor Primário
- TX; Expessura tumoral Breslow não pode ser avaliada (ex. curetagem/cortes tangenciais)
- T0; Não há evidência de tumor primário (desconhecido, regressão total)
- Tis; Melanoma in situ
- T1; Melanomas com 1.0 mm ou menos de espessura
- T2; Melanomas > 1 mm até 2.0 mm de espessura
- T3; Melanomas > 2 mm até 4.0 mm de espessura
- T4; Melanomas > de 4.0 mm de espessura
A subclassificação a e b para T é determinada pela presença ou ausência de ulceração de acordo com a Tabela 1.
Tabela 1 Subclassificação do tumor (melanoma cutâneo) segundo ulceração.
| Classificação T | Espessura em mm | Ulceração |
| T1 | ≤ 1 | Não avaliável
a: < 0,8 sem ulceração b: < 0,8 com ulceração 0,8-1,0 com ou sem ulceração |
| T2 | >1 até 2 | Não avaliável
a: sem ulceração b: com ulceração |
| T3 | >2 até 4 | Não avaliável
a: sem ulceração b: com ulceração |
| T4 | >4 | Não avaliável
a: sem ulceração b: com ulceração |
N-Metastase Loco Regionais (Nodais e não Nodais)
- NX -Pacientes cujos linfonodos não podem ser acessados (ex. previamente removidos por outra razão)
- N0 -Nenhuma metástase regional detectada
- N 1-3 -Metástases regional baseada no numero de linfonodos com metástases e presença ou ausência de metástase linfonodal, satélite (SAT), microssatélite (MSAT ou metástase em transito (MIT).
NOTA: Subclassificação N 1 a 3 e a – b – c, obedece a tabela abaixo:
Tabela 2 Subclassificação das metástases loco – regionais no melanoma cutâneo
| Classificação | N | Nº de linfonodos com metástase | SAT,MSAT ou MT |
| N1 | 1LN (+) ou SAT, MSAT ou MT | ||
| N1a | N1 (sn) | não | |
| N1b | N1 | não | |
| N1c | Linfonodo negativo | sim | |
| N2 | 2 ou 3 LN (+) ou 1 LN (+) SAT, MSAT ou MIT* | ||
| N2a | N2 (sn) | não | |
| N2b | N2 | não | |
| N2c | N1 (sn) ou N1 | sim | |
| N3 | 4 ou mais LN (+) ou 2 ou 3LN (+) de SAT, MSAT ou MIT* | ||
| N3a | N4 (sn) ou mais | não | |
| N3b | N4 ou LN coalescente | não | |
| N3c | N2 (sn) e/ou N2 e/ou qq LN coalescente | sim | |
* SAT: satelitose: MSAT: microsatelitose: MIT: metástase em trânsito
* sn: linfonodo sentinela
M- Metástases à distância
- M0 – Metástases distantes não detectáveis
- M1- Metástases à distancia
- M1a – Metástases para pele, tecidos moles, ou linfonodos não regionais
- M1b- Metástases para pulmão associada ou não a M1a
- M1c- Metástases para todos os outros órgãos associada ou não a M1a e M1b
- M1d-Metastases cerebrais associadas ou não a M1a, M1b e Ma1c
Tabela 3 Subclassificação das metástases no melanoma cutâneo segundo a LDH no soro
| Classificação M | Local
|
LDH* no soro |
| M1a | Pele, tecidos moles ou linfonodos não regionais | M1a 0 Normal
M1a 1 Elevada |
| M1b | Metástases pulmonares com ou sem M1a | M1b 0 Normal
M1b 1 Elevada |
| M1c | Todas as outras Metástases viscerais com ou sem M1a, M1a e M1b
Exceto SNC |
M1c 0 Normal
M1c 1 Elevada
|
| M1d | Metástase para SNc com ou sem M1a, M1b e M1c | M1d 0 Normal
M1c 1 Elevada |
NOTA: LDH no soro é incorporada na categoria M.
V.Bibliografia
- Smoller BR; Gershenwald JE; Scolyer RA et al. Protocol for the Examination of Specimens from Patients with Melanoma of the Skin. College of American Pathologists (CAP), June 2017.
- Gershenwald JE, Scolyer RA, Hess KR, Thompson JF et al .Melanoma of the Skin. In Amin MB, Edge SB, Greene FL et al. (Eds) AJCC Cancer Staging Manual, 8th Ed. New York: Springer, 2017.
- Swetter SM, Tsao H, Bichakjian CK et al. Guidelines of care for the management of primary cutaneous melanoma. J Am Acad Dermatol. 2019; 80:209-250.
Apêndice
- O papel do patologista nos estudos moleculares do melanoma
- Nos últimos dez anos, grandes avanços ocorreram no entendimento das vias de sinalização na gênese do melanoma. Este progresso resultou em numerosos protocolos clínicos de terapia, tendo como objetivo bloquear sítios específicos em moléculas essenciais à sobrevivência das neoplasias, ditas terapias alvo. Entretanto, a cada dia surgem novos relatos de resistência pelo encontro de mutações em diferentes vias de sinalização (Kudchadkar et al. 2012). Para exemplificar, a seguir serão descritos os casos de mutação dos genes BRAF e CKIT.
I. Gene BRAF:
I.1 Introdução:
- Algumas mutações tornam a via permanentemente ativada, resultando em estímulo permanente à proliferação celular. Em melanomas, este tipo de ativação ocorre, entre outros, na via MAPK (proteína quinases ativadas por mitógenos) (Sullivan and Flaherty 2012). As mutações de um dos componentes desta via, BRAF (proteína quinase do tipo serina-treonina) são encontradas em 50 a 70% das lesões. Sua frequência é significantemente alta nos melanomas extensivos superficiais. A mutação de BRAF mais frequente é a substituição de timina por adenina no códon 1796, dando origem a mutação V600E (substituição do aminoácido valina por ácido glutâmico na posição 600 da proteína) no éxon 15 do gene. A terapia-alvo com anticorpos anti-BRAF (e.g.: Sorafenib, Vemurafenib), introduzida em pacientes portadores de melanomas metastáticos disseminados, levou a extensas remissões, porém efêmeras, com duração de aproximadamente 6 meses, seguidas de recrudescimento da doença, resultante da proliferação de células com mutações em outros genes desta e de outras vias de sinalização (Flaherty et al., 2012; Flaherty, 2010).
I. 2 Procedimento para fazer a pesquisa de mutação do gene BRAF
Os protocolos de pesquisa foram desenhados para pacientes em estádios avançados. Portanto, as terapêuticas foram desenhadas para mutações de BRAF em lesões metastáticas e não em tumores primários. Entretanto, a literatura mais recente tende a permitir o exame de tumores primários em casos específicos onde não há possibilidade de análise do tecido metastático. Há diversas formas de se detectar mutações de BRAF: por sequenciamento direto, sequenciamento de nova geração, por pirosequenciamento, por PCR através do COBAS®. Desde que validados, estes métodos têm sensibilidade e especificidade muito próximas. Entretanto, os métodos para pesquisa de mutação específica, como o PCR ou Pirosequenciamento não permitem verificar variantes ou outras mutações passíveis de terapia alvo, embora sejam rápidos e custo específico mais baixo. É recomendável que o laboratório participe de programa de validação de sua tecnologia, para controle de qualidade comparativa a laboratórios de referência (Richman et al. 2018, Hartmann et al. 2019).
I.3 Material enviado para teste
Embora o material a congelado seja superior ao parafinado, na prática, este ultimo tem sido utilizado com mais frequência. O material deverá preferencialmente ser fixado em formol tamponado a 10% *. Deve-se encaminhar para teste o bloco de parafina, tomando-se o cuidado de escolher aquele que tiver mais tecido neoplásico íntegro.
II. Gene CKIT:
II.1 Introdução
O KIT é um RTK (receptor tirosine kinase) para o SCF (stem cell factor), que é um fator de crescimento para os melanócitos que afeta a melanogênese, proliferação, migração e sobrevivência. A terapêutica para alguns tipos de leucemia e para o Tumor Gastrointestinal Estromal (GIST) com Imatinib resultou em significativo avanço terapêutico. Em pacientes com melanomas acrais-lentiginosos e de mucosas com mutação no exon 11 de KIT (Torres-Cabala et al. 2009), o tratamento com Imatinib foi eficaz em pequena porcentagem de pacientes (Yamaguchi et al. 2011).
II.2 Procedimento para fazer a pesquisa de mutação do gene
O exame imuno-histoquímico para CD117 pode resultar positivo, porém há necessidade de realizar o sequenciamento direto para o gene KIT, que não está disponível em grande parte do território nacional.
II.3 Material enviado para teste
O material deverá preferencialmente ser fixado em formol tamponado a 10% *. Deve-se encaminhar para teste o bloco de parafina da metástase, tomando-se o cuidado de escolher aquele que tiver mais tecido neoplásico íntegro.
*Nota: Numerosas pesquisas demonstram que tecidos fixados em formol tamponado são muito superiores para a extração de DNA utilizado no sequenciamento. Os patologistas devem estar atentos a esta prática, pois os novos testes moleculares serão diretamente dependentes da qualidade do tecido enviado.
III. Outras moléculas:
Numerosos outros testes moleculares estão sendo desenvolvidos para protocolos de terapia-alvo. Destacam-se estudos com PTEN, AKT, Bcl-2, N-RAS, H-RAS, NF1 entre outros (Siroy et al. 2015)(Bedikian et al. 2006), (Kwong et al. 2012),(Zhu, Zhou and Sadri 2018, Stahl et al. 2004).
Em relação à imunoterapia, alguns estudos com inibidores de pontos de checagem imune, como PD-L1, têm sido avaliados como parâmetro para introdução desta modalidade de terapia. Tem-se utilizado o limiar de 1% de positividade para indicação terapêutica. Alguns autores têm dispensado este tipo de estudo(Schadendorf et al. 2018, Wolchok et al. 2017).
IV. Bibliografia
Bedikian, A. Y., M. Millward, H. Pehamberger, R. Conry, M. Gore, U. Trefzer, A. C. Pavlick, R. DeConti, E. M. Hersh, P. Hersey, J. M. Kirkwood, F. G. Haluska & O. M. S. Group (2006) Bcl-2 antisense (oblimersen sodium) plus dacarbazine in patients with advanced melanoma: the Oblimersen Melanoma Study Group. J Clin Oncol, 24, 4738-45.
Hartmann, A., P. Schirmacher, W. Sterlacci, W. Koch, D. B. Liesenfeld, B. Schif & C. Garbe (2019) BRAF mutation testing in melanoma: results from a German observational multicenter study. Virchows Arch, 474, 71-78.
Kwong, L. N., J. C. Costello, H. Liu, S. Jiang, T. L. Helms, A. E. Langsdorf, D. Jakubosky, G. Genovese, F. L. Muller, J. H. Jeong, R. P. Bender, G. C. Chu, K. T. Flaherty, J. A. Wargo, J. J. Collins & L. Chin (2012) Oncogenic NRAS signaling differentially regulates survival and proliferation in melanoma. Nat Med, 18, 1503-10.
Richman, S. D., J. Fairley, J. A. Hall, N. Nataraj, M. Bhide, A. Lau, K. L. Norman & Z. C. Deans (2018) Results of the UK NEQAS for Molecular Genetics reference sample analysis. J Clin Pathol, 71, 989-994.
Schadendorf, D., A. C. J. van Akkooi, C. Berking, K. G. Griewank, R. Gutzmer, A. Hauschild, A. Stang, A. Roesch & S. Ugurel (2018) Melanoma. Lancet, 392, 971-984.
Siroy, A. E., G. M. Boland, D. R. Milton, J. Roszik, S. Frankian, J. Malke, L. Haydu, V. G. Prieto, M. Tetzlaff, D. Ivan, W. L. Wang, C. Torres-Cabala, J. Curry, S. Roy-Chowdhuri, R. Broaddus, A. Rashid, J. Stewart, J. E. Gershenwald, R. N. Amaria, S. P. Patel, N. E. Papadopoulos, A. Bedikian, W. J. Hwu, P. Hwu, A. Diab, S. E. Woodman, K. D. Aldape, R. Luthra, K. P. Patel, K. R. Shaw, G. B. Mills, J. Mendelsohn, F. Meric-Bernstam, K. B. Kim, M. J. Routbort, A. J. Lazar & M. A. Davies (2015) Beyond BRAF(V600): clinical mutation panel testing by next-generation sequencing in advanced melanoma. J Invest Dermatol, 135, 508-15.
Stahl, J. M., A. Sharma, M. Cheung, M. Zimmerman, J. Q. Cheng, M. W. Bosenberg, M. Kester, L. Sandirasegarane & G. P. Robertson (2004) Deregulated Akt3 activity promotes development of malignant melanoma. Cancer Res, 64, 7002-10.
Sullivan, R. J. & K. Flaherty (2012) MAP kinase signaling and inhibition in melanoma. Oncogene.
Torres-Cabala, C. A., W. L. Wang, J. Trent, D. Yang, S. Chen, J. Galbincea, K. B. Kim, S. Woodman, M. Davies, J. A. Plaza, J. W. Nash, V. G. Prieto, A. J. Lazar & D. Ivan (2009) Correlation between KIT expression and KIT mutation in melanoma: a study of 173 cases with emphasis on the acral-lentiginous/mucosal type. Mod Pathol, 22, 1446-56.
Wolchok, J. D., V. Chiarion-Sileni, R. Gonzalez, P. Rutkowski, J. J. Grob, C. L. Cowey, C. D. Lao, J. Wagstaff, D. Schadendorf, P. F. Ferrucci, M. Smylie, R. Dummer, A. Hill, D. Hogg, J. Haanen, M. S. Carlino, O. Bechter, M. Maio, I. Marquez-Rodas, M. Guidoboni, G. McArthur, C. Lebbé, P. A. Ascierto, G. V. Long, J. Cebon, J. Sosman, M. A. Postow, M. K. Callahan, D. Walker, L. Rollin, R. Bhore, F. S. Hodi & J. Larkin (2017) Overall Survival with Combined Nivolumab and Ipilimumab in Advanced Melanoma. N Engl J Med, 377, 1345-1356.
Yamaguchi, M., K. Harada, N. Ando, T. Kawamura, N. Shibagaki & S. Shimada (2011) Marked response to imatinib mesylate in metastatic acral lentiginous melanoma on the thumb. Clin Exp Dermatol, 36, 174-7.
Zhu, M. L., L. Zhou & N. Sadri (2018) Comparison of targeted next generation sequencing (NGS) versus isolated BRAF V600E analysis in patients with metastatic melanoma. Virchows Arch, 473, 371-377.
Voltar para a página inicial do manual