Fernando Augusto Soares
Isabela Werneck da Cunha
Códigos de topografia
C60 Neoplasia maligna do pênis
C60.0 Prepúcio
C60.1 Glande
C60.2 Corpo do pênis
C60.8 Lesão invasiva do pênis
C60.9 Pênis, não especificado
- Identificação e resumo clínico
- Dados clínicos relevantes
III. Procedimento
- Biópsia incisional
- Biópsia excisional
- Penectomia parcial
- Penectomia total
- Circuncisão
- Outro (especificar) _________________
- Achados macroscópicos
Sítio tumoral (se múltiplos sítios estiverem envolvidos, marcar todos os que se aplicarem)
- Glande
- Superfície mucosa do prepúcio
- Superfície cutânea do prepúcio
- Sulco coronal (sulco balanoprepucial)
- Pele do corpo peniano
- Uretra peniana
Focalidade tumoral
- Unicêntrico
- Multicêntrico
Tamanho do espécime ____ cm
Tamanho do tumor: maior dimensão ____ cm
Tipo de prepúcio
- Longo
- Médio
- Curto
Achados macroscópicos do tumor (marcar todos os que se aplicarem)
- Plano
- Ulcerado
- Polipoide
- Verruciforme
- Necrose
- Hemorragia
- Outros (especificar) _____________
Base tumoral de infiltração
- Expansiva (base ampla)
- Infiltrativa, mas bem circunscrita
- Infiltrativa, irregular
- Outra (especificar) _____________
Extensão macroscópica do tumor
Na glande
- O tumor envolve a lâmina própria
- O tumor envolve o corpo esponjoso
- O tumor envolve a túnica albugínea
- O tumor envolve o corpo cavernoso
- O tumor envolve a uretra distal (peniana)
No prepúcio
- O tumor envolve a lâmina própria
- O tumor envolve o darto
- O tumor envolve a pele prepucial
No corpo do pênis
- O tumor envolve a pele
- O tumor envolve o darto
- O tumor envolve a fáscia de Buck
- O tumor envolve o corpo cavernoso
- O tumor envolve a uretra proximal
Avaliação macroscópica das margens de ressecção
- Não podem ser avaliadas
- Macroscopicamente não envolvidas
- Macroscopicamente envolvidas
Apenas para espécimes de penectomia
- Uretral
- Tecidos periuretrais (lâmina própria, corpo esponjoso, fáscia de Buck)
- Corpos cavernosos
- Fáscia de Buck no corpo do pênis
- Pele
- Outras (especificar) ____________
Para espécimes de circuncisão
- Margem do sulco coronal
- Margem cutânea
- Achados microscópicos
V.1 Tipo histológico
- Carcinoma de células escamosas
- Usual (ceratinizante)
- Basalóide
- Basalóide, variante papilífera
- Warty (condilomatoso)
- Warty (basaloide)
- Verrucoso
- Verrucoso, misto ou híbrido
- Cuniculatum
- Papilífero, SOE
- Sarcomatóide
- Pseudo-hiperplásico
- Acantolítico (pseudoglandular)
- Medular
- Misto
- Adenoescamoso
- Carcinoma de células claras
- Carcinoma neuroendócrino primário
- Doença de Paget
- Carcinoma anexial (especificar tipo) _____________
- Outro (especificar) _____________
- Carcinoma, tipo não pode ser determinado
V.2 Grau histológico
- G1 – Bem diferenciado
- G2 – Moderadamente diferenciado
- G3 – Pouco diferenciado
V.3 Marcadores prognósticos histológicos
- Níveis anatômicos de invasão
- Profundidade tumoral ou espessura (mm)
- Margens de ressecção
- Invasão vascular
- Invasão perineural
- Índice prognóstico
V.3.1 Níveis anatômicos de invasão
Na glande
- O tumor envolve a lâmina própria
- O tumor envolve o corpo esponjoso
- O tumor envolve a túnica albugínea
- O tumor envolve o corpo cavernoso
No sulco coronal
- O tumor envolve a lâmina própria
- O tumor envolve o darto
- O tumor envolve a fáscia de Buck
No prepúcio
- O tumor envolve a lâmina própria
- O tumor envolve o darto
- O tumor envolve a pele prepucial
No corpo
- O tumor envolve a pele
- O tumor envolve o darto
- O tumor envolve a fáscia de Buck
- O tumor envolve o corpo esponjoso
- O tumor envolve o corpo cavernoso
Outras extensões
- Uretra peniana distal
- Uretra proximal
- Próstata
- Escroto
- Pele regional (pubiana, inguinal)
V.3.2 Espessura tumoral/profundidade ____ mm
V.3.3 Margens de ressecção
- Não podem ser avaliadas
- Histologicamente não envolvidas
- Histologicamente envolvidas (especificar) ______________
Apenas para espécimes de penectomia
- Uretral
- Tecidos periuretrais (lâmina própria, corpo esponjoso, fáscia de Buck)
- Corpos cavernosos
- Fáscia de Buck no corpo do pênis
- Pele
- Outras (especificar) _____________
Para espécimes de circuncisão
- Margem do sulco coronal
- Margem cutânea
V.3.4 Invasão vascular/linfática (vasos grandes/pequenos)
- Não identificada
- Presente
- Indeterminada
V.3.5 Invasão perineural (ver XII.10)
- Não identificada
- Presente
- Indeterminada
V.3.6 Índice Prognóstico:
- Baixo Risco para metástases linfonodais: 2-4 pontos
- Risco Intermediário para metástases linfonodais: 5-6 pontos
- Risco alto para metástases linfonodais: 7 pontos
- Grau histológico
- Bem diferenciado: 1 ponto
- Moderadamente diferenciado: 2 pontos
- Pouco diferenciado: 3 pontos
- Nível Anatômico da Invasão
- Lâmina própria: 1 ponto
- Corpo esponjoso/dartos: 2 pontos
- Corpo cavernoso/pele do prepúcio: 3 pontos
- Invasão Perineural
- Ausente: 0 ponto
- Presente: 1 ponto
Achados patológicos adicionais
- Nenhum identificado
- Neoplasia peniana intraepitelial (PeIN)
- Diferenciada
- Indiferenciada
- Warty
- Basaloide
- Warty/basaloide
- Mista diferenciada/indiferenciada
- Focal
- Multifocal
- Margens não envolvidas
- Margens envolvidas (especificar a margem) ___________
- Outra (especificar) ___________
- Líquen escleroso
- Hiperplasia escamosa
- Condiloma acuminado
- Outros (especificar) ___________
- Estudos auxiliares
Imuno-histoquímica, hibridização in situ, PCR (especificar) ___________
VII. Avaliação dos linfonodos inguinais
Linfadenectomia
- Biópsia de linfonodo-sentinela
- Inguinais (superficiais e profundos)
- Ilíacos externos
- Ilíacos internos
- Linfonodos pélvicos
- Outros (especificar) _____________
Número de linfonodos envolvidos por local _____________
Ruptura capsular
Invasão da gordura perinodal
VIII. Avaliação de secções de congelação
Margens de ressecção
- Uretra
- Corpos cavernosos
- Pele e fáscia do corpo
- Sulco coronal em espécimes de circuncisão
- Linfonodos-sentinela
- Outros linfonodos (especificar) _____________
- Estadiamento patológico (pTNM)
T – Tumor primário
- TX – O tumor primário não pode ser avaliado
- T0 – Sem evidência de tumor primário
- Tis – Carcinoma in situ
- Ta – Carcinoma Epidermóide localizado, não invasivo*
- pT1:
- Glande: tumor invade a lâmina própria
- Pele: Tumor invade a derme, lâmina própria ou a fáscia Dartos
- Corpo do Pênis: Invade o tecido conjuntivo entre a epiderme e a corpora local
- Todos os sítios: tumor sem invasão linfovascular, invasão perineural e que não seja de alto grau histológico
- T1a – O tumor invade o tecido conectivo subepitelial sem invasão linfovascular (ILV), invasão peri-neural e não é pouco diferenciado
- T1b – O tumor invade o tecido conectivo subepitelial com ILV, invasão peri-neural ou é pouco diferenciado (alto grau histológico)
- T2 – O tumor invade o corpo esponjoso ou cavernoso com ou sem invasão da uretra
- T3 – O tumor invade o corpo cavernoso (incluindo a túnica albigínea) independente da invasão uteral
- T4 – O tumor invade outras estruturas adjacentes (escroto, próstata, osso púbico)
N – Linfonodos regionais
Definição de estágio clínico*
- cNX – Os linfonodos regionais não podem ser avaliados
- cN0 – Linfonodos inguinais visíveis ou palpáveis não são vistos
- cN1 – Linfonodo inguinal móvel palpável unilateral
- cN2 – Linfonodos inguinais palpáveis móveis maior ou igual a dois unilateral ou bilaterais
- cN3 – Massa nodal inguinal fixa palpável ou linfadenopatia pélvica unilateral ou bilateral
* Nota: Baseado em palpação e/ou imagens.
Definição de estágio patológico*
- pNX – Os linfonodos regionais não podem ser avaliados
- pN0 – Ausência de metástases em linfonodos regionais
- pN1 – Metástases em um ou dois linfonodo(s) inguinal, sem extensão extra-nodal
- pN2 – Metástases em três ou mais linfonodos inguinais múltiplos ou bilaterais
- pN3 – Metástases linfonodais com extensão extranodal ou em linfonodos pélvicos unilaterais ou bilaterais
* Nota: Baseado em biópsia ou excisão cirúrgica.
M – Metástases a distância
- M0 – Ausência de metástases a distância
- M1 – Metástases a distância*
* Nota: Metástases em linfonodos fora da pelve verdadeira em adição a sítios viscerais ou ósseos.
Descritor adicional
O sufixo “m” indica a presença de múltiplos tumores primários e é relatado entre parênteses – p. ex., pTa (m) N0M0.
- Grupos de estadiamento anatômico/prognóstico
Tabela 1 Grupos de estadiamento anatômico/prognóstico do carcinoma do pênis.
| Grupo | T | N | M |
| Estádio 0is | Tis | N0 | M0 |
| Ta | N0 | M0 | |
| Estádio I | T1a | N0 | M0 |
| Estadio IIA | T1b | N0 | M0 |
| T2 | N0 | M0 | |
| Estádio IIB | T3 | N0 | M0 |
| Estádio IIIa | T1-3 | N1 | M0 |
| Estádio IIIb | T1-3 | N2 | M0 |
| Estádio IV | T4 | Qualquer N | M0 |
| Qualquer T | N3 | M0 | |
| Qualquer T | Qualquer N | M1 |
- Fatores prognósticos específicos
Tabela 2 Fatores prognósticos específicos do carcinoma do pênis.
| Requerido para estadiamento | Nenhum |
| Clinicamente significativo | Envolvimento do corpo esponjoso Envolvimento do corpo cavernoso Porcentagem de tumor que é pobremente diferenciado Invasão perineural/vascular Tamanho da maior metástase em linfonodo Extensão extranodal/extracapsular |
XII. Comentários gerais
XII.1 Tipos de prepúcio
Há três tipos de prepúcio: curto, quando o orifício prepucial é localizado aquém da corona da glande; médio, quando o orifício está entre a corona e o orifício meatal; longo, quando toda a glande está recoberta e o meato não é identificado sem retrair o prepúcio. Prepúcios fimóticos são longos (Velazquez et al., 2003). A fimose está presente em até metade dos pacientes com carcinoma do pênis (Velazquez et al., 2003) e a sua presença é considerada um fator de risco para o desenvolvimento desse tumor (Daling et al., 2005; Madsen et al., 2008; Tsen et al., 2001).
XII.2 Número de linfonodos envolvidos e extensão da linfadenectomia
Mais de dois linfonodos positivos em uma bacia inguinal aumentam a probabilidade de envolvimento nodal contralateral inguinal e pélvico ipsilateral (Kroon et al.,2005; Lont et al., 2007). A linfadenectomia profilática inguinal contralateral e pélvica ipsilateral é recomendada em tais casos. O número de linfonodos positivos envolvidos também tem impacto na sobrevida (Pandey et al., 2006).
XII.3 Infiltração da base tumoral
Dois padrões são reconhecidos: infiltrativo (blocos de pequenas fitas sólidas de células tumorais infiltrando amplamente o estroma) e infiltração expansiva (células tumorais invadindo em grandes blocos, com interface tumoral-estromal bem definida). O padrão infiltrativo de invasão é associado com maior risco de envolvimento nodal (Guimarães et al., 2006). Carcinomas verrucosos (base larga) devem ser excluídos quando se avalia o impacto prognóstico do padrão de invasão do front tumoral, uma vez que eles não estão associados com metástases nodais.
XII.4 Subtipos histológicos de carcinoma de células escamosas
A maioria é de carcinomas de células escamosas (CCE) se originando do epitélio da mucosa da porção distal do pênis (glande, sulco coronal e superfície mucosa do prepúcio). O CCE do tipo usual (CCE queratinizante) é o mais comum, em 50 a 60% dos casos (Cubilla et al., 2004; Epstein et al., 2011; Velazquez et al., 2009). Há outras variantes distintivas (Cubilla et al., 2004; Velazquez et al., 2009). Os diferentes subtipos se correlacionam com diferentes índices de disseminação regional/nodal e de disseminação sistêmica. Subtipos de câncer do pênis podem ser prognosticamente estratificados em três (Guimarães et al., 2009): o grupo de baixo risco inclui tumores verruciformes, como carcinomas verrucosos, papilíferos e warty/condilomatosos (Cubilla et al., 2000; Cubilla et al., 2001b). Subtipos descritos mais recentemente, como pseudo-hiperplásico e carcinoma cuniculatum do pênis, também pertencem a essa categoria de excelente prognóstico (Barreto et al., 2007; Cubilla et al., 2004). A categoria de alto risco é compreendida por CCE de tipo usual basaloide, sarcomatoide, adenoescamoso e pobremente diferenciado (Cubilla et al., 1996; Cubilla et al., 1998; Velazquez et al., 2005). Há uma categoria com risco metastático intermediário que inclui CCE de tipo usual, algumas neoplasias mistas (como carcinomas verrucosos híbridos) e variantes de alto risco de carcinomas warty/condilomatosos (Cubilla et al., 2000). Outros subtipos recentemente descritos de CCE do pênis são o carcinoma warty-basaloide (Chaux et al., 2009) e a variante papilífera do carcinoma basaloide (Cubilla et al., 2004), ambas relacionadas com HPV.
XII.5 Grau histológico
O grau histológico é um fator preditivo de metástases na virilha e disseminação do câncer do pênis (Chaux et al., 2009ab; Slaton et al., 2001; Velazquez et al., 2008). Os autores recomendam o seguinte método de graduação:
- Grau 1: é um carcinoma extremamente bem diferenciado, com desvio mínimo da histologia do epitélio escamoso normal/hiperplásico.
• Grau 2: mostra crescimento mais desorganizado, comparado com lesões grau 1, maior índice núcleo-citoplasma, mitoses evidentes e, embora presente, queratinização menos proeminente.
• Grau 3: são tumores que mostram qualquer proporção de células anaplásicas, identificadas como lençóis sólidos ou pequenos agregados irregulares, cordões ou ninhos de células com pouca ou nenhuma queratinização, alto índice núcleo/citoplasma, membranas nucleares espessas, pleomorfismo nuclear, comatina grumosa, nucléolo proeminente e numerosas mitoses (Velazquez et al., 2008).
Cada tumor deve ser graduado de acordo com o componente menos diferenciado. Qualquer proporção de células anaplásicas é suficiente para classificar um tumor como grau 3 (Chaux et al., 2009b).
XII.6 Extensão tumoral
Tumores invadindo níveis anatômicos mais profundos do pênis usualmente são associados com maior risco de envolvimento nodal. Há também uma correlação entre infiltração mais profunda e maior grau histológico, embora algumas exceções ocorram (Guimarães et al., 2009). Tumores invadindo o corpo cavernoso têm maior risco de apresentar metástases nodais do que os que invadem apenas o corpo esponjoso (Chaux et al., 2009ab; Leijte et al., 2008) e o tecido erétil mais profundo invadido deve ser claramente reportado no relatório patológico final.
XII.7 Profundidade da invasão
A profundidade tumoral em lesões pequenas é mais bem avaliada seccionando-se o local perpendicularmente em relação ao eixo central do tumor. Para grandes tumores da glande, prefere-se seccionar o espécime longitudinalmente em duas metades, com secções paralelas adicionais de cada metade, usando como eixo a uretra peniana central e ventral. A profundidade da invasão do CCE é medida em milímetros da junção epitelial-estromal do epitélio adjacente não neoplásico até a porção mais profunda da invasão. Em tumores maiores, especialmente nos verruciformes, o sistema mencionado não é aplicável e prefere-se medir a espessura da superfície (excluindo a camada de queratina) até a porção mais profunda da invasão. A profundidade da invasão e a espessura do tumor têm significados equivalentes. Há correlação entre a profundidade da invasão e a evolução nos cânceres do pênis. Risco mínimo de metástases foi relatado para tumores medindo menos de 5 mm de espessura (Emerson et al., 2001; Velazquez et al., 2008).
XII.8 Margens de ressecção
Margens positivas afetam adversamente o prognóstico de pacientes com carcinomas de células escamosas do pênis (Epstein et al., 2011; Velazquez et al., 2004; 2009).
Margens importantes, em espécimes de penectomia parcial, são:
- Uretra proximal e um cilindro de tecido periuretral circunjacente consistindo de epitélio, lâmina própria, corpo esponjoso e fáscia peniana.
• Porção proximal do corpo peniano com corpo cavernoso separado e circundado pela túnica albugínea e fáscia de Buck.
• Pele do corpo peniano com darto corporal subjacente (Velazquez et al., 2004). A margem do sulco coronal e a margem cutânea devem ser inteiramente examinadas quando se avaliam espécimes de circuncisão.
XII.9 Invasão vascular/linfática
A invasão vascular, linfática ou venosa, afeta adversamente o prognóstico do câncer peniano (Ficarra et al., 2005, 2006; Kattan et al., 2006; Lopes et al., 1996; Novara et al., 2007). A classificação de estadiamento TNM (AJCC, 2010) subdivide os tumores T1 em T1a e T1b, com base na ausência ou na presença de invasão linfovascular ou tumores pouco diferenciados (Edge et al., 2010). Êmbolos tumorais em espaços vasculares usualmente estão próximos do front tumoral invasivo, mas podem ser encontrados a distância do tumor primário, na lâmina própria, na fáscia peniana e no tecido conectivo subepitelial periuretral. A invasão venosa indica um estágio mais avançado da doença e está relacionada ao comprometimento das estruturas eréteis especializadas dos corpos esponjoso e cavernoso.
XII.10 Nomogramas, grupos de risco e invasão perineural
Foi desenvolvida uma avaliação prognóstica dos dados clínicos e patológicos usando um nomograma (Ficarra et al., 2006). Os fatores selecionados foram: estádio clínico dos linfonodos, padrão de crescimento microscópico, grau, invasão vascular, invasão dos corpos esponjoso e cavernoso e uretra. A probabilidade de metástases nodais, como prevista pelo nomograma, foi próxima da incidência real de metástases observada no seguimento. Um segundo nomograma para estimar as previsões de sobrevida em 5 anos, usando os mesmos fatores clínicos e patológicos, obteve resultados similares (Kattan et al., 2006).
Mais recentemente, foi demonstrado que a invasão perineural e o grau histológico são os fatores preditivos independentes mais fortes de mortalidade em tumores penianos com espessura de 5 a 10 mm. Para isso, foi construído outro nomograma considerando o valor preditivo de invasão perineural e grau histológico (Velazquez et al., 2008). Sistemas de estratificação de grupos de risco estão disponíveis para prever a probabilidade de envolvimento nodal inguinal e o planejamento terapêutico, e são baseados em uma combinação de grau histológico, nível anatômico mais profundo de infiltração e presença de invasão perineural. Esses fatores são usados para construir o índice prognóstico (Chaux et al., 2009a).
XII.11 Neoplasia intraepitelial peniana
A neoplasia intraepitelial peniana (PeIN) pode ser subclassificada em diferenciada e indiferenciada. A PeIN diferenciada mostra paraqueratose, espessamento epitelial, alongamento dos cones interpapilares, pontes proeminentes, atipia de células basais, núcleos aumentados e nucléolos proeminentes; é frequentemente associada com líquen escleroso; é considerada não relacionada ao papilomavírus humano (HPV), não há coilocitose e a coloração imuno-histoquímica com p16 usualmente é negativa. A PeIN indiferenciada é subclassificada nos tipos basaloide, warty e warty-basaloide. A PeIN basaloide é caracterizada pela substituição do epitélio normal por células pequenas e uniformes com núcleos redondos e citoplasma escasso. Numerosas mitoses e células apoptóticas estão presentes. A PeIN do tipo warty mostra a superfície espiculada com paraqueratose. O epitélio normal é substituído por células marcadamente pleomórficas mostrando coilocitose proeminente. As lesões mistas warty-basaloides não são infrequentes. As PeIN warty e basaloide são lesões relacionadas com HPV, que superexpressam p16. Raramente há combinações de PeIN diferenciada e indiferenciada no mesmo espécime.
XIII. Manuseio do espécime (ver fascículo de tumores do pênis, em Epstein et al., 2011)
XIII.1 Espécime de circuncisão (Figura 1)
Determinar o tipo de prepúcio. Tomar medidas, descrever o espécime e identificar e descrever o tumor. Identificar e pintar as margens mucosa e cutânea com cores diferentes. A maioria dos CCE se origina na superfície mucosa do prepúcio, portanto, a margem (mucosa) do sulco coronal é especialmente importante. Delicadamente distender e fixar o espécime com alfinetes em um cartão. Fixar por várias horas em formalina a 10%, tamponada. Cortar verticalmente todo o espécime, rotulando de 1 a 12, no sentido dos ponteiros do relógio.
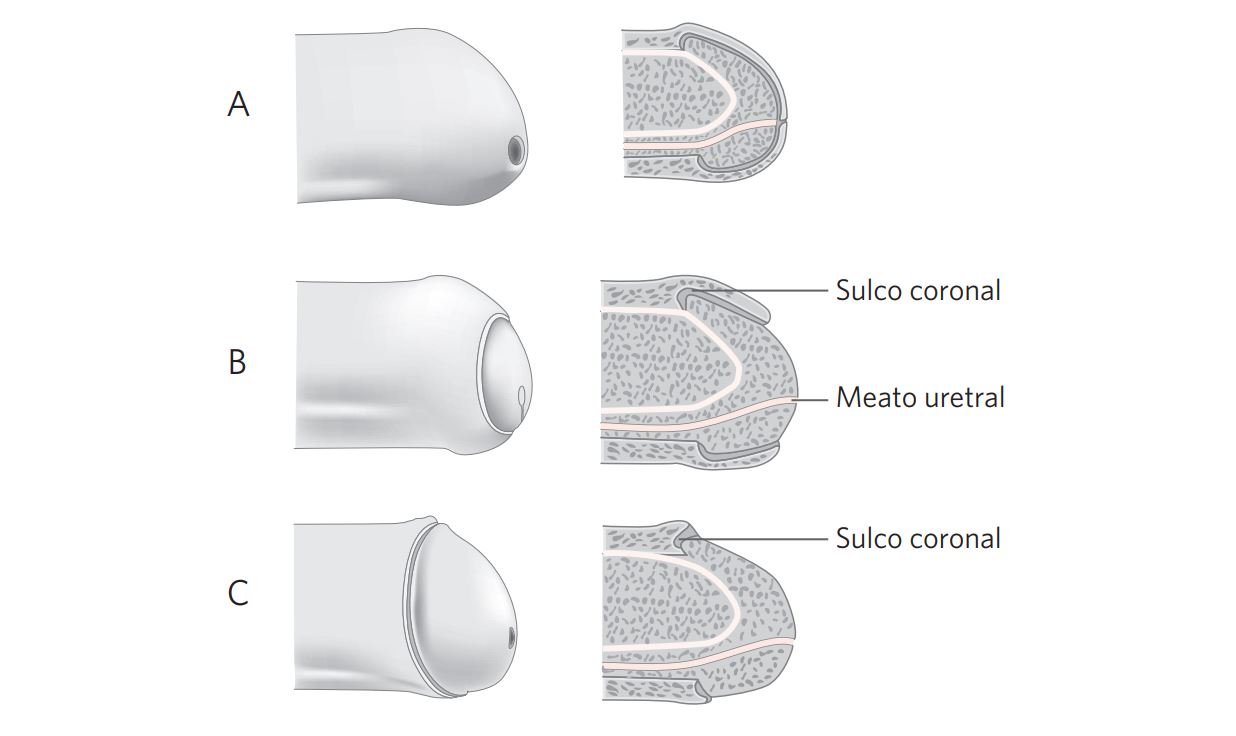
Figura 1 Tipos de prepúcio: longo ou fimótico (A), médio (B) e curto (C).
XIII.2 Espécime de penectomia (Figuras 2 a 6)
Tomar as medidas, descrever o espécime e identificar e descrever o tumor. A maioria dos CCE do pênis se origina do epitélio da porção distal do órgão (glande, sulco coronal e superfície mucosa do prepúcio). O tumor pode envolver um ou mais desses compartimentos anatômicos (Cubilla et al., 2001a). Se presente, classificar o prepúcio em (1) curto, (2) médio e (3) longo e/ou fimótico (Velazquez et al., 2003). Cortar a margem proximal de ressecção em face, assegurando-se de incluir a circunferência inteira da uretra. Se a uretra se retraiu, é importante identificar a margem de ressecção e submetê-la inteiramente. A margem de ressecção pode ser dividida em três importantes áreas que necessitam ser analisadas: a pele do corpo peniano com o darto subjacente e a fáscia peniana; os corpos cavernosos com albugínea; e a uretra com um cilindro periuretral que inclua lâmina própria, corpo esponjoso, albugínea e fáscia peniana. A uretra e o cilindro periuretral podem ser colocados em um cassete. A pele do corpo peniano com o darto e a fáscia podem ser incluídos junto com o corpo cavernoso. Como este é um grande espécime, pode ser necessário utilizar vários cassetes para incluir toda a margem de ressecção. Fixar o restante do espécime a noite toda. Quando o espécime estiver fixado, e se o tumor for grande e envolver a maior parte da glande, cortar longitudinal e centralmente, usando o meato e a uretra proximal como pontos de referência. Não sondar a uretra. Separar o espécime em duas metades, esquerda e direita. Então, cortar duas a seis secções seriadas de cada metade. Se o tumor for pequeno e assimétrico, localizado na área ventral ou dorsal, a porção central do tumor pode ser usada como eixo de secção. Se o tumor for grande e envolver vários locais (glande, sulco e prepúcio), é importante não remover o prepúcio, deixando o espécime intacto para ser seccionado.
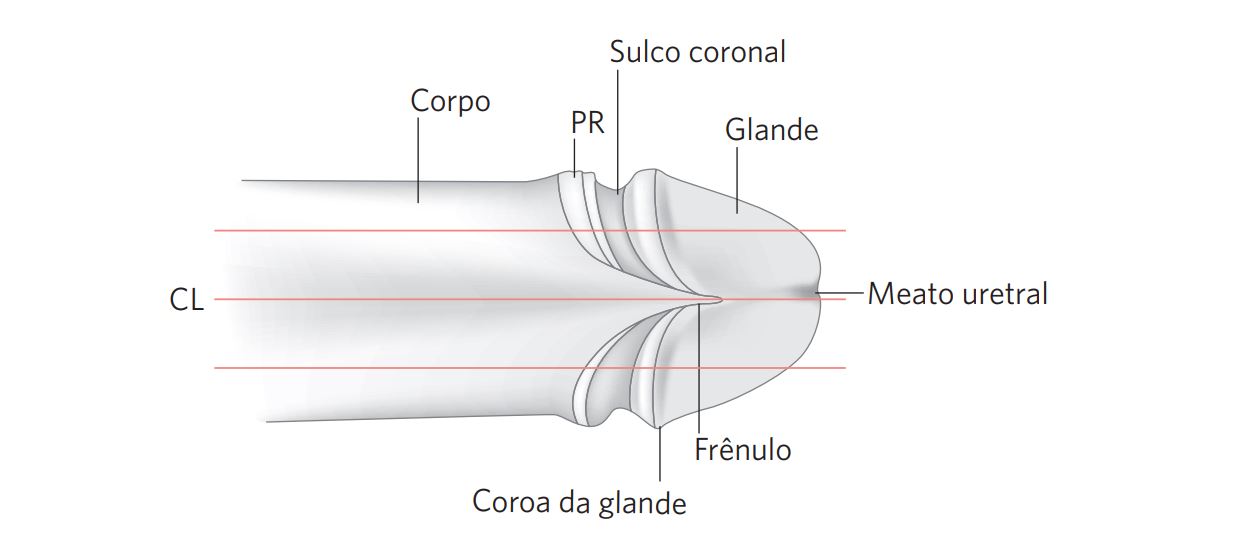
Figura 2 Representação diagramática de uma penectomia parcial, mostrando o corpo, o prepúcio retraído (PR), o sulco coronal, a glande, o meato uretral, o frênulo e a coroa da glande.
As linhas horizontais indicam os planos de secção.
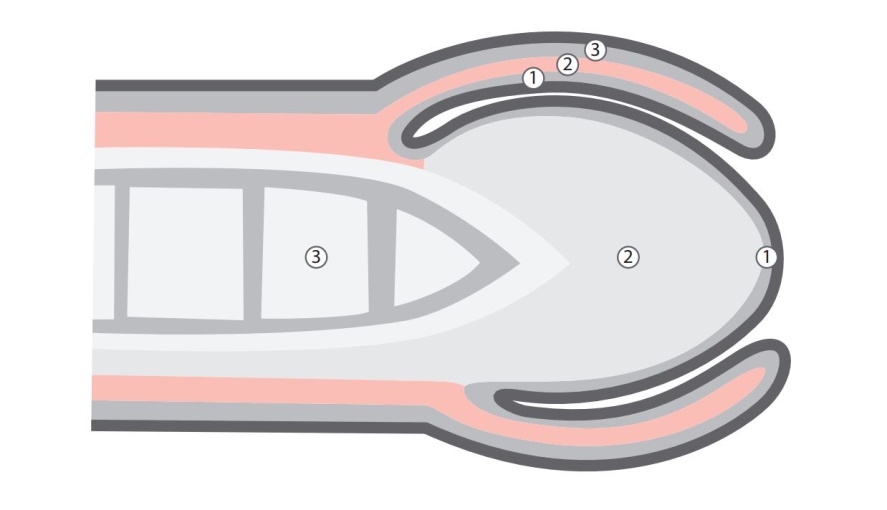
Figura 3 Níveis anatômicos, indicados por números. Acima, no prepúcio, 1 é a lâmina própria, 2 o darto e 3 a pele do prepúcio. Abaixo, há níveis anatômicos na glande: 1 é a lâmina própria, 2 o corpo esponjoso e 3 o corpo cavernoso.
Em casos de pequenos carcinomas localizados exclusivamente na glande, sem envolvimento do prepúcio, pode-se optar por remover o prepúcio, deixando uma borda redundante de 3 mm ao redor do sulco. Seccionar o prepúcio como indicado para os espécimes de circuncisão. Mesmo que o tumor primário seja localizado na glande, submeter o prepúcio serial e ordenadamente, rotulado de 1 a 12 no sentido dos ponteiros do relógio. O restante do espécime da penectomia deve ser encaminhado como descrito.
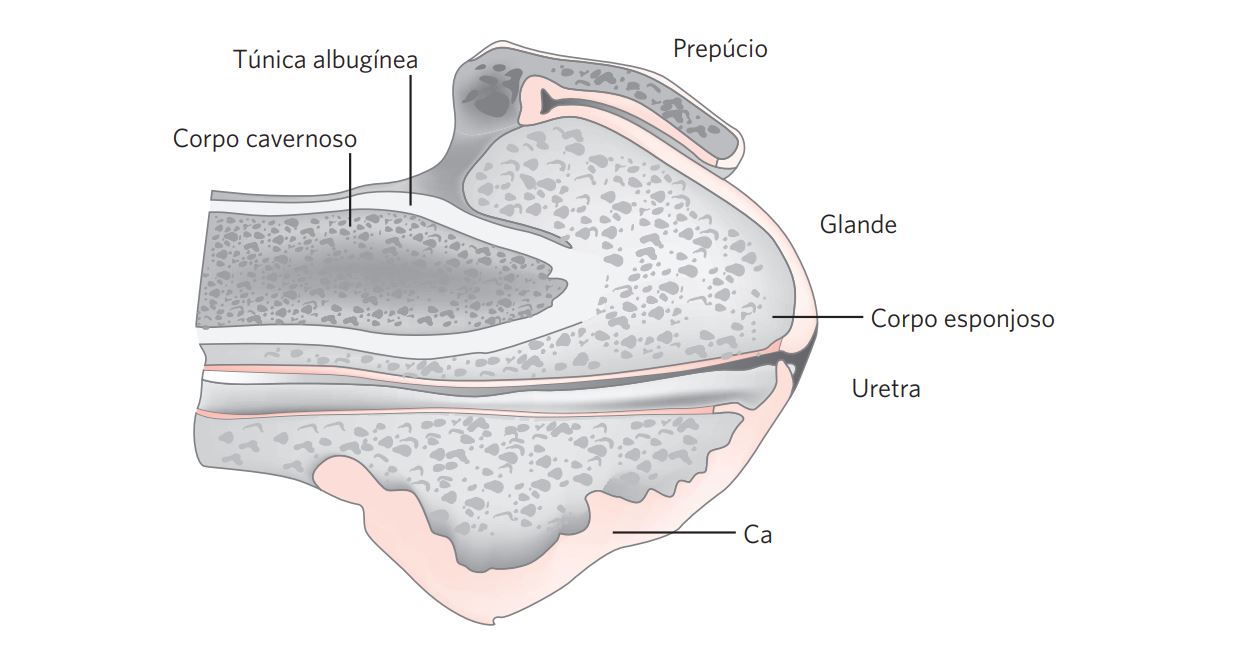
Figura 4 Secção longitudinal e central de uma penectomia parcial com um CCE de disseminação superficial (Ca), mostrando a uretra, a glande e o prepúcio. A túnica albugínea separa o corpo esponjoso do corpo cavernoso.
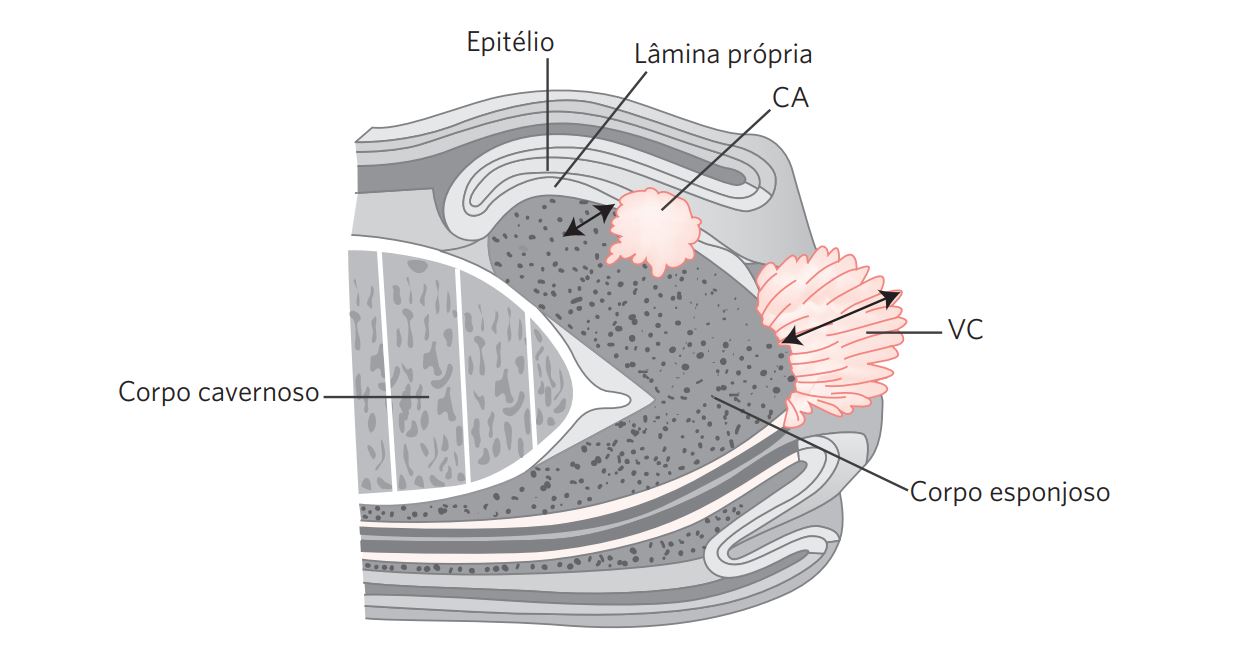
Figura 5 Secção de corte de um diagrama representando uma penectomia parcial com dois tumores (Ca e VC). A seta indica a medida da profundidade do tumor no primeiro e a espessura tumoral no segundo.

Figura 6 Margem de ressecção na uretra e nos tecidos periuretrais. Os sítios usualmente positivos (em 12 pacientes) estão indicados pelas marcas coloridas.
XiV. relatório patológico para o CCe do pênis
O relatório deve conter as seguintes informações: sítio ou sítios do tumor, tamanho (em cm), subtipos histológicos, grau histológico, níveis anatômicos de invasão, espessura do tumor (em mm), fronte de invasão, invasão perineural e vascular, margens de ressecção, lesões neoplásicas e não neoplásicas associadas. O uso de nomogramas, índice prognóstico e outros métodos de agrupar os fatores de risco do paciente é opcional. O estado nodal é detalhado, como segue: número e tamanho, sítio e estado capsular. Todos os linfonodos devem ser incluídos para exame microscópico. A distinção entre linfonodos inguinais superficiais e profundos foi eliminada na última classificação TNM (Edge et al., 2010). Imuno-histoquímica, ISH ou PCR podem ser necessários em alguns casos: carcinomas sarcomatoides, hiperplasia versus PeIN diferenciada, lesões pré-cancerosas ou tumores invasivos HPV versus não HPV-relacionados.
Bibliografia
Barreto J, Velazquez EF, Ayala E, Torres J, Cubilla AL. Carcinoma cuniculatum: a distinctive variant of penile squamous cell carcinoma: report of 7 cases. Am J Surg Pathol 2007; 31(1):71-5.
Chaux A, Caballero C, Soares F, Guimarães GC, Cunha IW, Reuter V et al. The prognostic index: a useful pathologic guide for prediction of nodal metastases and survival in penile squamous cell carcinoma. Am J Surg Pathol 2009a; 33(7):1049-57.
Chaux A, Torres J, Pfannl R, Barreto J, Rodriguez I, Velazquez EF et al. Histologic grade in penile squamous cell carcinoma: visual estimation versus digital measurement of proportions of grades, adverse prognosis with any proportion of grade 3 and correlation of a Gleason-like system with nodal metastasis. Am J Surg Pathol 2009b; 33(7):1042-8.
Cubilla AL, Ayala MT, Barreto JE, Bellasai JG, Nöel JC. Surface adenosquamous carcinoma of the penis: a report of three cases. Am J Surg Pathol 1996; 20(2):156-60.
Cubilla AL, Dillner J et al. Malignant epithelial tumours. In: Eble J, Sauter G, Epstein J, Sesterhenn I (eds.). World Health Organization classification of tumours. Pathology & genetics of tumours of the urinary system and male genital organs. Lyon: IARC, 2004a.
Cubilla AL, Piris A, Pfannl R, Rodriguez I, Agüero F, Young RH. Anatomic levels: important landmarks in penectomy specimens: a detailed anatomic and histologic study based on examination of 44 cases. Am J Surg Pathol 2001a; 25(8):1091-4.
Cubilla AL, Reuter VE, Gregoire L, Ayala G, Ocampos S, Lancaster WD et al. Basaloid squamous cell carcinoma: a distinctive human papilloma virus-related penile neoplasm: a report of 20 cases. Am J Surg Pathol 1998; 22(6):755-61.
Cubilla AL, Reuter VE, Velazquez E, Piris A, Saito S, Young RH. Histologic classification of penile carcinoma and its relation to outcome in 61 patients with primary resection. Int J Surg Pathol 2001b; 9(2):111-20.
Cubilla AL, Velazques EF, Reuter VE, Oliva E, Mihm Jr MC, Young RH. Warty (condylomatous) squamous cell carcinoma of the penis: a report of 11 cases and proposed classification of ‘verruciform’ penile tumors. Am J Surg Pathol 2000; 24(4):505-12.
Cubilla AL, Velazquez EF et al. Identification of prognostic pathologic parameters in squamous cell carcinoma of the penis: significance and difficulties. Path Case Rev 2005; 10(1):3-13.
Cubilla AL, Velazquez EF, Young RH. Pseudohyperplastic squamous cell carcinoma of the penis associated with lichen sclerosus. An extremely well-differentiated, nonverruciform neoplasm that preferentially affects the foreskin and is frequently misdiagnosed: a report of 10 cases of a distinctive clinicopathologic entity. Am J Surg Pathol 2004; 28(7):895-900.
Daling JR, Madeleine MM, Johnson LG, Schwartz SM, Shera KA, Wurscher MA et al. Penile cancer: importance of circumcision, human papillomavirus and smoking in in situ and invasive disease. Int J Cancer 2005; 116(4):606-16.
Edge SE, Byrd DR et al. (eds.). AJCC cancer staging manual. New York: Springer, 2010.
Emerson RE, Ulbright TM, Eble JN, Geary WA, Eckert GJ, Cheng L. Predicting cancer progression in patients with penile squamous cell carcinoma: the importance of depth of invasion and vascular invasion. Mod Pathol 2001; 14(10):963-8.
Epstein JH, Humphrey PA et al. Tumors of the prostate gland, seminal vesicles, male urethra, penis and scrotum. Washington: Armed Forces Institute of Pathology, 2011.
Ficarra V, Zattoni F, Artibani W, Fandella A, Martignoni G, Novara G et al.; GUONE Penile Cancer Project Members. Nomogram predictive of pathological inguinal lymph node involvement
in patients with squamous cell carcinoma of the penis. J Urol 2006;175(5):1700-4.
Ficarra V, Zattoni F, Cunico SC, Galetti TP, Luciani L, Fandella A et al.; Gruppo Uro-Oncologico del Nord Est (Northeast Uro-Oncological Group) Penile Cancer Project. Lymphatic and vascular embolizations are independent predictive variables of inguinal lymph node involvement in patients with squamous cell carcinoma of the penis: Gruppo Uro-Oncologico del Nord Est (Northeast Uro-Oncological Group) Penile Cancer data base data. Cancer 2005; 103(12):2507-16.
Guimarães GC, Cunha IW, Soares FA, Lopes A, Torres J, Chaux A et al. Penile squamous cell carcinoma clinicopathological features, nodal metastasis and outcome in 333 Cases. J Urol 2009; 182(2):528-34.
Guimarães GC, Lopes A, Campos RS, Zequi Sde C, Leal ML, Carvalho AL et al. Front pattern of invasion in squamous cell carcinoma of the penis: new prognostic factor for predicting
risk of lymph node metastases. Urology 2006; 68(1):148-53.
Hungerhuber E, Schlenker B, Karl A, Frimberger D, Rothenberger KH, Stief CG et al. Risk stratification in penile carcinoma: 25-year experience with surgical inguinal lymph node staging. Urology 2006; 68(3):621-5.
Kattan M, Ficarra V, Artibani W, Cunico SC, Fandella A, Martignoni G et al.; GUONE Penile Cancer Project Members. Nomogram predictive of cancer specific survival in patients undergoing partial or total amputation for squamous cell carcinoma of the penis. J Urol 2006; 175(6):2103-8.
Kroon BK, Horenblas S, Nieweg OE. Contemporary management of penile squamous cell carcinoma. J Surg Oncol 2005; 89(1):43-50.
Leijte J, Gallee M, Antonini N, Horenblas S. Evaluation of current TNM classification of penile carcinoma. J Urol 2008; 180(3):933-8.
Lont A, Kroon B, Gallee MP, van Tinteren H, Moonen LM, Horenblas S. Pelvic lymph node dissection for penile carcinoma: extent of inguinal lymph node involvement as an indicator for pelvic lymph node involvement and survival. J Urol 2007; 177(3):947-52.
Lopes A, Hidalgo GS, Kowalski LP, Torloni H, Rossi BM, Fonseca FP. Prognostic factors in carcinoma of the penis: multivariate analysis of 145 patients treated with amputation and lymphadenectomy. J Urol 1996; 156(5):1637-42.
Madsen BS, van den Brule AJ, Jensen HL, Wohlfahrt J, Frisch M. Risk factors for squamous cell carcinoma of the penis – population-based case-control study in Denmark. Cancer Epidemiol Biomarkers Prev 2008; 17(10):2683-91.
Novara G, Galfano A, De Marco V, Artibani W, Ficarra V. Prognostic factors in squamous cell carcinoma of the penis. Nat Clin Pract Urol. 2007;4(3):140-6.
Ornellas AA, Nóbrega BL, Wei Kin Chin E, Wisnescky A, da Silva PC, de Santos Schwindt AB. Prognostic factors in invasive squamous cell carcinoma of the penis: analysis of 196 patients treated at the Brazilian National Cancer Institute. J Urol 2008; 180(4):1354-9.
Pandey D, Mahajan V, Kannan RR. Prognostic factors in node-positive carcinoma of the penis. J Surg Oncol 2006; 93(2): 133-8.
Slaton J, Morgenstern N, Levy DA, Santos Jr MW, Tamboli P, Ro JY et al. Tumor stage, vascular invasion and the percentage of poorly differentiated cancer: independent prognosticators for inguinal lymph node metastasis in penile squamous cancer. J Urol 2001; 165(4):1138-42.
Solsona E, Algaba F, Horenblas S, Pizzocaro G, Windahl T; European Association of Urology. EAU Guidelines on Penile Cancer. Eur Urol 2004; 46(1):1-8.
Solsona E, Iborra I, Rubio J, Casanova JL, Ricós JV, Calabuig C. Prospective validation of the association of local tumor stage and grade as a predictive factor for occult lymph node micrometastasis in patients with penile carcinoma and clinically negative inguinal lymph nodes. J Urol 2001; 165(5):1506-9.
Tsen HF, Morgenstern H, Mack T, Peters RK. Risk factors for penile cancer: results of a population-based case-control study in Los Angeles County (United States). Cancer Causes Control 2001; 12(3):267-77.
Velazquez EF, Ayala G, Liu H, Chaux A, Zanotti M, Torres J et al. Histologic grade and perineural invasion are more important than tumor thickness as predictor of nodal metastasis in penile squamous cell carcinoma invading 5 to 10 mm. Am J Surg Pathol 2008; 32(7):974-9.
Velazquez EF, Barreto JE et al. The penis. Sternberg’s diagnostic surgical pathology. In: Sternberg SS, Mills SHE, Carter D (eds.). Diagnostic surgical pathology. Philadelphia: Lippincott Williams & Wilkins – Raven; 2009.
Velazquez EF, Bock A, Soskin A, Codas R, Arbo M, Cubilla AL. Preputial variability and preferential association of long phimotic foreskins with penile cancer: an anatomic comparative study of types of foreskin in a general population and cancer patients. Am J Surg Pathol 2003; 27(7):994-8.
Velazquez EF, Melamed J, Barreto JE, Aguero F, Cubilla AL. Sarcomatoid carcinoma of the penis: a clinicopathologic study of 15 cases. Am J Surg Pathol 2005; 29(9):1152-8.
Velazquez EF, Soskin A, Bock A, Codas R, Barreto JE, Cubilla AL. Positive resection margins in partial penectomies: sites of involvement and proposal of local routes of spread of penile squamous cell carcinoma. Am J Surg Pathol 2004; 28(3):384-9.
Esse capítulo é uma versão revisada e parcialmente modificada da publicação do College American Pathologists Protocol for the examination of specimens from patients with carcinoma of the penis. O protocolo foi baseado no AJCC Cancer Staging Handbook – from the AJCC Cancer Staging Manual. 7. ed. New York: Springer, 2010; e revisado pela doutora Elsa F. Velazquez e pelo doutor Antonio L. Cubilla (autor deste capítulo).
Voltar para a página inicial do manual
