Humberto Carvalho Carneiro
Códigos de topografia
C54 Neoplasia benigna da glândula tireoide
C73 Neoplasia maligna da glândula tireoide
- Identificação e resumo clínico
- Dados clínicos relevantes
Eutireoidismo, hipotireoidismo, hipertireoidismo, eutireoidismo compensado
Tratamento prévio
- Não
- Sim (especificar)[1] ________________
Radiação prévia de cabeça e pescoço (terapêutica ou ocupacional) ou exposição aguda a radiação (ex: acidente nuclear)
- Não
- Sim (especificar) ________________
História familiar de doenças da tireoide, síndrome de neoplasia endócrina múltipla (NEM), síndromes hereditárias com predisposição ao câncer, incluindo Síndrome de Tumor PTEN-Hamartoma, Li Fraumeni e Síndrome de Lynch
Estudo ultrassonográfico
- Não realizado
- Realizado (diagnóstico com número e localização de nódulos, descrição e categoria TIRADS)
Estudo cintilográfico
- Não realizado
- Realizado
- Nódulo quente
- Nódulo frio
Estudo citológico
[1] Inclui ablação por radiofrequência de nódulos tireoidianos
- Não realizado
- Realizado (diagnóstico, descrição microscópica e categoria Bethesda)
Data ___ /___ /___
Exames laboratoriais
- Não realizados
- Realizados
- Provas de função tireoidiana
- Anticorpos
- PTH, calcitonina
III. Procedimento cirúrgico
- Lobectomia
- Direita
- Esquerda
- Istmectomia
- Tireoidectomia parcial
- Hemitireoidectomia direita (lobo direito e parte do istmo)
- Hemitireoidectomia esquerda (lobo esquerdo e parte do istmo)
- Ressecções parciais de lobos e nodulectomias
- Totalização de tireoidectomia
- Tireoidectomia total
- Tireoidectomia total com dissecção de linfonodos do compartimento central (níveis VI – peritireoidianos, pré-traqueais, paratraqueais, délficos ) ou mediastinais altos (nível VII )
- Tireoidectomia total com dissecção de linfonodos laterais (níveis I a V)
- Outro procedimento (especificar) ___________________
- Não especificado
NOTA: especificar na descrição do material porções mergulhantes/intratorácicas de bócios mais volumosos.
- Exame de congelação
- Não realizado
- Do(s) tumor(es)
- Negativo/Benigno
- Doença nodular folicular da tireoide
- Tireoidite
- outros
- Positivo (vide classificação abaixo)
- Aguardar parafina
- Lesão folicular encapsulada
- Outros
- Negativo/Benigno
- Do(s) linfonodo(s)
- Negativo
- Positivo
- Aguardar parafina
- De lesões peritireoidianas
- Paratireoide normal
- Adenoma de paratireoide
- Exame macroscópico
Fixação do espécime
- A fresco
- Formalina tamponada a 10%
- Outro fixador (especificar) ________________
Órgão(s) e/ou tecido(s) recebido(s) ________________
Dimensões e peso do espécime (especificar o tamanho total da glândula e de cada lobo/istmo, nos eixos superior-inferior; látero-lateral e ântero-posterior)
- Medidas ___ x ___ x ___ cm
- Peso ____ g
Características da superfície externa do espécime: cor, estado da cápsula, retrações, soluções de continuidade
Paratireoide(s)
- Não
- Sim
- Localização
- Número
- Dimensões ___ x ___ x ___ cm
Presença de tecido não tireoidiano
- Não
- Sim (especificar) _____________
Quantidade de nódulos _____________
Localização do(s) nódulo(s)
- Lobo direito, terço superior/médio/inferior
- Lobo esquerdo, terço superior/médio/inferior
- Istmo
Dimensão(ões) do(s) nódulo(s) ___ x ___ x ___ cm
Características do(s) nódulo(s):
- Delimitação
- Encapsulado(s)
- Não encapsulado(s), bem delimitado(s)
- Mal delimitado(s), Infiltrativo(s)
- Consistência/Aspecto
- Coloide
- Sólido
- Sólido-cístico
- Cístico
- Cor
- Outras alterações
- Necrose
- Calcificações
- Hemorragia
- Distância da margem radial/cápsula
Nota: Caso haja mais de um tumor, a descrição macroscópica deve ser feita para cada um, separadamente. Em caso de múltiplos nódulos por toda a tireoide, a descrição detalhada pode ser feita só com os nódulos dominantes e/ou suspeitos, o restante descrito como “aspecto multinodular” típico da doença nodular folicular da tireoide.
Linfadenectomia
- Não
- Sim
- A fresco
- Fixado (especificar) ______________
- Localização de cada grupo de linfonodos ______________
- Número de linfonodos ______________
- Dimensões de linfonodo(s) ______________
V.1 Processamento macroscópico
Além dos procedimentos de rotina, é obrigatório (para orientação mais detalhada ver comentários no final deste capítulo):
- Orientar a peça cirúrgica: determinar o que é anterior/posterior, superior/inferior e direito/esquerdo. Por vezes, a orientação do espécime pode ser difícil. Para auxílio, o istmo pode ser usado para identificação da porção inferior da glândula e a superfície posterior é geralmente mais côncava e cruenta do que a anterior, que é bosselada e mais lisa.
- Analisar a superfície externa da glândula, verificando a presença de tecido ou estruturas extratireoidianas, como segmento de músculo esquelético, linfonodos e paratireoides.
- Pintar a superfície externa de acordo com o protocolo do serviço.
V.3 Laudo macroscópico (exemplo)
Produto de tireoidectomia total. Recebido, em formalina para exame anatomopatológico convencional, glândula tireoide medindo 4,0 x 5,1 x 1,5 cm e pesando 18g. O lobo direito mede 4,0 x 1,6 x 1,3 cm (pintado em verde), o istmo mede 1,2 x 2,0 x 0,8 cm (pintado em preto) e o lobo esquerdo mede 3,5 x 1,5 x 1,5 cm (pintado em amarelo), nos eixos superior-inferior, látero-lateral e ântero-posterior, respectivamente. A superfície externa é bosselada e lobulada, revestida por fina cápsula transparente, com aderência de pequeno feixe muscular no terço médio do lobo direito. Aos cortes sequenciais em fatias perpendiculares aos eixos longitudinais, observam-se 2 nódulos:
Nódulo 1: localizado em terço médio direito, em correspondência ao feixe muscular citado, medindo 1,5 x 1,0 x 1,0 cm, infiltrativo, de aspecto sólido e coloração esbranquiçada. Não há extensão macroscópica ao fragmento de músculo identificado;
Nódulo 2: localizado em terço superior esquerdo, medindo 0,9 x 0,8 x 0,8 cm, parcialmente encapsulado, de aspecto coloide e coloração acastanhada
O parênquima adjacente é castanho e de aspecto carnoso, sem outras alterações macroscópicas.
Acompanha produto de linfadenectomia cervical do nível VI direito, que consta de segmento irregular de gordura medindo 2,0 x 1,5 x 1,0 cm. Aos cortes, foram isolados 3 nódulos pardos e elásticos, o maior medindo 0,4 x 0,3 cm.
Fragmentos representativos são submetidos a exame microscópico.
Cassetes:
Lobo direito, terço superior, 2F/1C; Lobo direito, terço médio e nódulo 1 (todo incluído), 4F/2C; Lobo direito, terço inferior, 2F/1C; Istmo, 3F/1C; Lobo esquerdo, terço superior e nódulo, 2 2F/2C; Lobo esquerdo, terço médio, 2F/2C; Lobo esquerdo terço inferior, 2F/2C; Linfonodos nível VI direito, 3F/1C.
- Exame microscópico
VI.1 Tipo histológico
VI.1.1 Tumores benignos
- Doença nodular folicular da tireoide (nomenclatura aceitável: Hiperplasia nodular)
- Adenoma folicular
- Adenoma folicular com arquitetura papilífera
- Adenoma oncocítico da tireoide
- Outros (inclui cistos tireoidianos, paratireoides intratireoidianas e outras lesões incomuns)
VI.1.2 Tumores de baixo risco
- Neoplasia folicular não-invasiva da tireoide com características nucleares papilífero-símiles (NIFTP)
- Tumor trabecular hialinizante
- Tumores de potencial de malignidade incerto, subtipos (necessariamente um subtipo deve ser atribuído):
- Tumor folicular de potencial de malignidade incerto (FT-UMP)
- Tumor bem diferenciado de potencial de malignidade incerto (WDT-UMP)
VI.1.3 Carcinomas de tireoide
VI.1.3.1 Carcinomas de derivação folicular
- Carcinoma folicular da tireoide, subtipos (necessariamente um subtipo deve ser atribuído)
- Minimamente invasivo
- Encapsulado, angioinvasivo
- Extensamente invasivo
- Carcinoma papilífero da tireoide (necessariamente um subtipo deve ser atribuído):
- Folicular, encapsulado, invasivo
- Folicular, infiltrativo
- Clássico
- Clássico, encapsulado
- Esclerosante difuso
- Sólido/trabecular
- Warthin-símile
- Oncocítico
- Células claras
- Fusocelular
- Com estroma tipo fibromatose desmoide/fasciíte-símile
- Células altas
- Hobnail
- Células colunares
- Carcinoma oncocítico da tireoide, subtipos (necessariamente um subtipo deve ser atribuído)
- Minimamente invasivo
- Encapsulado, angioinvasivo
- Extensamente invasivo
- Carcinomas de derivação folicular de alto grau (necessariamente um subtipo deve ser atribuído)
- Carcinoma diferenciado da tireoide de alto grau (papilífero, folicular ou oncocítico)
- Carcinoma pouco diferenciado da tireoide
- Carcinoma anaplásico da tireoide (nomenclatura aceitável: carcinoma indiferenciado da tireoide)
VI1.3.2 Carcinomas derivados de células C
- Carcinoma medular da tireoide (padrão citoarquitetural pode ser relatado)
- Microcarcinoma medular da tireoide
VI1.3.3 Carcinomas mistos de derivação folicular e de células C
- Carcinoma misto medular-folicular
- Carcinoma misto medular-papilífero
- Carcinoma misto medular e oncocítico
- Carcinoma misto medular e pouco diferenciado
- Carcinoma misto medular e anaplásico
VI1.3.4 Carcinomas tipo glândula salivar da tireoide
- Carcinoma mucoepidermoide
- Carcinoma secretor (evitar termo “MASC”)
VI1.3.5 Tumores de histogênese incerta
- Carcinoma morular-cribriforme
- Carcinoma mucoepidermoide esclerosante com eosinofilia
VI1.3.6 Tumores tímicos intratireoidianos
- Timoma (classificar segundo o subtipo)
- Tumor epitelial fusiforme com elementos tímico-símiles (SETTLE)
- Carcinoma tímico intratireoidiano (aceitável: carcinoma intratireoidiano com elementos tímico-símiles – CASTLE)
VI1.3.7 Tumores embrionários
- Tireoblastoma (evitar “teratoma imaturo, teratoma maligno, carcinossarcoma”)
VI1.3.7 Outros tumores
- Linfomas, plasmocitoma primário
- Paraganglioma
- Tumor fibroso solitário
- Tumores de células dendríticas foliculares
- Histiocitose de células de Langerhans
- Tumores secundários
- Outros tumores___
VI.2 Padrões citoarquiteturais/subtipos observados (para o carcinoma papilífero da tireoide, carcinoma pouco diferenciado e carcinoma anaplásico)
VI2.1 Proporção em % de cada subtipo por nódulo, especialmente subtipos de comportamento agressivo (ver exemplo abaixo)
VI.3 Focalidade
VI3.1 Número de focos tumorais
VI.4 Localização (por nódulo, correspondente ao exame macroscópico)
VI.5 Tamanho do tumor ou do maior foco tumoral
VI.6 Invasão vascular (vasos venosos)
- Presente
- Focal (menos de 4 vasos)[1]
- Extensa (4 ou mais vasos)
- Ausente
VI7. Invasão linfática
- Presente
- Disseminação intratireoidiana (intraparenquimatosa)
- Ausente
VI8. Infiltração perineural
- Presente
- Ausente
VI9. Índice mitótico
- Não foram detectadas figuras de mitose
- __ mitoses/2 mm2
VI10. Necrose tumoral
[2] A informação do número de focos de invasão vascular deve ser feita apenas para carcinomas foliculares e oncocíticos
- Presente
- Ausente
VI11. Extensão extratireoidiana microscópica
- Presente (especificar)
- Tecido adiposo peritireoidiano
- Paratireoide (por contiguidade)
- Tecido muscular esquelético
- Outras estruturas (especificar)
- Ausente
VI12. Extensão extratireoidiana macroscópica[1]
- Presente
- Músculo esquelético
- Esôfago
- Traqueia
- Pele
- Outros (especificar)
- Ausente
VI13. Margens cirúrgicas
- Todas as margens estão livres de neoplasia
- Margem radial coincidente com a neoplasia (especificar nódulo/topografia)
- Margem cirúrgica não avaliável
VI14. Relação entre a margem coincidente e a extensão extratireoidiana
- Não se aplica
- Não há correspondência entra margem comprometida e a extensão extratireoidiana
- Margem coincidente corresponde ao foco de extensão extratireoidiana
VI15. Linfonodos regionais
- Linfonodos não foram enviados ou isolados
- Foram isolados ____ linfonodos, todos livres de neoplasia
- Metástase de carcinoma ____ para ____ entre ____ linfonodos examinados
- Distribuição de linfonodos por cadeia:
- ____/____ linfonodos de cadeia ________ (especificar)
- Extensão extranodal
- Tamanho do maior foco metastático: ____ cm
- Presente
- Distribuição de linfonodos por cadeia:
[3] Devem ser considerados em conjunto os exames de imagem e os achados intraoperatórios
-
-
- Ausente
-
VI16. Outros achados:
- Doença nodular folicular da tireoide
- Tireoidite de Hashimoto
- Área de fibrose e hemorragia antiga consistente com sítio de punção
- Ninhos celulares sólidos (remanescentes do corpo ultimobranquial)
- Hiperplasia de células C
- outros
VI17. Paratireoides
- Número e localização das paratireoides detectadas ao exame macro ou microscópico
VII. Diagnóstico final (exemplo)
MICROSCOPIA (para o mesmo caso do exemplo macroscópico)
Produto de tireoidectomia total:
- Carcinoma papilífero da tireoide, subtipo de células altas
– Padrões citoarquiteturais observados: células altas: 40%/clássico: 60%
– Focalidade: tumor único
– Localização: terço médio do lobo direito (nódulo 1)
– Tamanho do tumor: 1,5 cm no maior eixo
– Invasão vascular venosa: ausente
– Invasão linfática: presente (disseminação intraparenquimatosa)
– Índice mitótico: 2/2mm2
– Necrose: ausente
– Extensão extratireoidiana microscópica: presente – a neoplasia invade o tecido fibroadiposo peritireoidiano, sem comprometimento do segmento de músculo esquelético aderido ao espécime
– Extensã0 extratireoidiana macroscópica: ausente
– Margens cirúrgicas: todas as margens estão livres de neoplasia
– Linfonodos regionais: metástase de carcinoma papilífero para 2 entre 3 linfonodos do nível VI direito enviados
– Tamanho do maior foco metastático: 1,0 mm
– Extensão extranodal: ausente
– Outros achados:
– Doença nodular folicular da tireoide (nódulo 2, lobo esquerdo)
– Detectadas duas áreas de fibrose com sinais de hemorragia antiga, consistentes com sítio de punção
– Paratireoides: detectada ao exame microscópico, uma paratireoide inferior esquerda, histologicamente normal
CONCLUSÃO (apenas achados mais relvantes e/ou com influência no estadiamento)
Produto de tireoidectomia total:
- Carcinoma papilífero da tireoide, subtipo de células altas
– Localização: terço médio do lobo direito
– Tamanho: 1,5 cm no maior eixo
– Extensão extratireoidiana: presente, microscópica
– Margens cirúrgicas: livres de neoplasia
– Linfonodos regionais: metástase de carcinoma papilífero para 2 entre 3 linfonodos do nível VI direito enviados
Estadiamento patológico (pTNM): pT1b pN1a
VIII. Comentários
Estadiamento patológico – pTNM para carcinomas de derivação folicular e carcinoma medular
pT – Tumor primário
- pTX – O tumor primário não pode ser avaliado
- pT0 – Sem evidências de tumor primário
- pT1 – Tumor medindo 2,0 cm ou menos, limitado à tireoide
- pT1a – Tumor com 1,0 cm ou menos na maior dimensão, limitado à tireoide
- pT1b – Tumor com mais de 1,0 cm, mas não maior do que 2,0 cm na maior dimensão, limitado à tireoide
- pT2 – Tumor com mais de 2 cm, mas não maior do que 4,0 cm, limitado à tireoide
- pT3 – Tumor com mais de 4,0 cm limitado à tireoide ou qualquer tumor com extensão extratireoidiana macroscópica (apenas para músculos “em fita”)
- pT3a – Tumor com mais de 4,0 cm limitado à tireoide
- P3b – Tumor de qualquer tamanho com extensão extratireoidiana macroscópica para músculos cervicais em fita (esterno-hioideo, esterno-tireoideo; tiro-hioideo e omo-hioideo)
- pT4 – Inclui extensão extratireoidiana além dos músculos em fita
- pT4a – Tumor de qualquer tamanho com extensão macroscópica em tecido subcutâneo, laringe, traqueia, esôfago ou nervo laríngeo recorrente
- pT4b – Tumor de qualquer tamanho com extensão macroscópica em fáscia pré-vertebral ou englobando a artéria carótida ou vasos mediastinais
Nota: Nos casos de tumores múltiplos, deve-se empregar o sufixo “m”, devendo-se utilizar o diâmetro do maior tumor para estadiamento final. Os prefixos “r” e “a” são utilizados para tumores recorrentes e tumores detectados em autópsias, respectivamente. Já o prefixo “y”, utilizado para tumores pós-tratamento neoadjuvante, não tem muita aplicabilidade em patologia de tireoide, mesmo em nódulos tratados previamente com técnicas alternativas como ablação por radiofrequência.
pN – Linfonodos regionais
- pNX – Os linfonodos regionais não podem ser avaliados
- pN0 – Ausência de metástases em linfonodos regionais
- pN0a – um ou mais linfonodos confirmados como benignos histologicamente ou citologicamente
- pN1 – Metástases para linfonodos regionais
- pN1a – Metástases para nível VI ou VII uni ou bilaterais (linfonodos pré-traqueais, paratraqueais e pré-laríngeos/Délficos ou mediastinais superiores)
- pN1b – Metástases para linfonodos de cadeias laterais (unilateral, bilateral ou contralateral) níveis I, II, III, IV e V ou retrofaríngeos
pM – Metástases a distância
- pM1 – Metástases a distância
NOTA: na definição de grupos prognósticos do estadiamento clínico, o carcinoma anaplásico da tireoide é sempre considerado estádio IV.
- IX. Considerações gerais
IX.1. O Exame intraoperatório da glândula tireoide
A frequência de realização do exame intraoperatório é bastante variável entre diferentes centros, o que pode ser explicado pela variação do próprio entendimento de suas indicações e benefícios pela equipe multidisciplinar. A evidência científica mostra de forma cada vez mais consistente que o exame intraoperatório da tireoide tem, em geral, baixa acurácia. Neste sentido, a decisão do procedimento cirúrgico a ser realizado deve se apoiar na conjunção entre um bom exame de imagem, o exame citopatológico (PAAF) adequado e interpretado por um especialista experiente e, em muitas instâncias, o desejo do paciente, este último orquestrado por uma relação médico-paciente clara e efetiva.
Embora a maioria dos pacientes que se submetem à tireoidectomia total ou parcial já tenham resultados de exames de imagem e citopatologia prévios, a grande demanda por congelações de tireoide em alguns serviços se impõe como um desafio para o patologista que, além da função de educar clínicos e cirurgiões, deve oferecer a melhor assistência possível dentro das limitações do método. Abaixo seguem alguns tópicos práticos que podem ser úteis para questões do dia a dia:

Qual o melhor método de avaliação? na vasta maioria das vezes, o exame intraoperatório se limita à análise macroscópica do espécime, acompanhada de esfregaços citológicos. Deve-se lembrar que o tecido tireoidiano tende a ficar artefatual em cortes de congelação. Assim, é possível interpretar núcleos de lesões benignas como irregulares, sobrepostos, levando a um diagnóstico falso-positivo de carcinoma papilífero. O clareamento nuclear do carcinoma papilífero, que é um artefato de pós-fixação, é melhor visto em amostras já processadas, e pode estar ausente tanto em esfregaços quanto em cortes congelados. Por outro lado, após a fixação, lesões benignas previamente congeladas podem apresentar intenso clareamento nuclear, dificultando o diagnóstico definitivo.
Avaliação de nódulos foliculares solitários. Com a tendência de se realizar cirurgias cada vez menos radicais, não é rara a demanda pela avaliação de nódulos foliculares solitários para decisão entre tireoidectomia total ou parcial. Aqui, a tentativa de fornecer um diagnóstico definitivo no intraoperatório pode resultar em uma mudança drástica de diagnóstico em cortes definitivos, especialmente em lesões encapsuladas em que o estudo da totalidade da cápsula/lesão não é factível. Assim, o exame deve ter a maior especificidade possível, definindo casos com características claras de malignidade e, nos demais casos, o cirurgião deve aguardar o diagnóstico definitivo para decisão de totalização da cirurgia em segundo tempo. Essa prática diminui a chance de uma tireoidectomia radical desnecessária.
Em 2001, um grupo da Johns Hopkins, realizou um estudo prospectivo para avaliar o exame de congelação em 61 pacientes com PAAF prévia de neoplasia folicular e nódulo solitário. Destes, 29 espécimes foram submetidos a exame de congelação e 32 foram enviados diretamente para exame histopatológico. Do grupo de congelação apenas 1 paciente teve diagnóstico de malignidade à congelação, os 28 restantes com “Neoplasia folicular ou de células de Hürthle”. Destes, 6 eram carcinomas foliculares na parafina. Do grupo não submetido à congelação, 3 foram diagnosticados como carcinomas de tireoide. Em conclusão, o grupo constatou que em 96,4% dos pacientes a congelação não foi nem informativa e nem custo-efetiva (gasto médio de $12,470 dólares por exame intraoperatório), desaconselhando a realização do procedimento na instituição.
Exames prévios. Valores de PTH e calcitonina, além das provas de função tireoidiana, devem ser interrogados ao cirurgião, especialmente em situações atípicas. Lesões periféricas retiradas como nódulos tireoidianos podem corresponder a adenomas de paratireoide, muitas vezes em pacientes sem provas laboratoriais disponíveis e com PAAF prévia de nódulo folicular tireoidiano. Tumores amarelados à macroscopia, com células plasmocitoides ou morfologia atípica para células foliculares nos esfregaços, podem corresponder a carcinomas medulares que não foram suspeitados no pré-operatório.
IX.2 O exame macroscópico
Pode ser realizado já no exame intraoperatório ou com a peça fixada, seguindo o as etapas abaixo:
Abordagem inicial. O espécime, quando recebido, deve ser pesado, medido em 3 dimensões, descrito, pintado e, se possível, fotografado, antes de ser integralmente seccionado em cortes sucessivos de 2 a 3 mm ao eixo longitudinal de cada lobo:
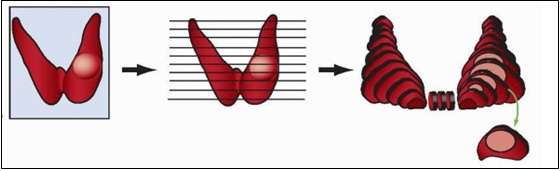
Fonte: Nikiforov Y. Diagnostic Pathology and Molecular Genetics of the Thyroid. 2009, Lippincott Williamns & Wilkins
Deve-se evitar seccionar a glândula no eixo longitudinal, pois disso resultam cortes geralmente mais grossos, como também em uma menor quantidade de cortes (menor superfície de área estudada) e em uma maior deformidade dos fragmentos após a fixação. A secção acompanhando o eixo longitudinal também facilita a correlação com os exames de imagem para localização dos nódulos nos terços superior, médio e inferior.
Cor, consistência e delimitação/cápsula. Parâmetros fundamentais para um bom exame macroscópico de lesões tireoidianas, que devem ser descritos de forma precisa.
O quanto representar? Algumas regras práticas, mas que não são absolutas, podem ser aplicadas a situações específicas, após exame macroscópico minucioso:
- Doença nodular folicular da tireoide (Hiperplasia nodular): 1 cassete para cada 5g da glândula em bócios muito volumosos, com foco em áreas nodulares ou 1 cassete por nódulo, se pertinente
- Nódulo mal definido, suspeito ou infiltrativo: submeter a totalidade se até 3 cm. Acima deste valor, incluir um cassete por cm, focando na interface com o parênquima (sem número máximo, pode ser incluída toda a interface)
- Nódulo encapsulado: submeter a totalidade se até 3 cm. Acima, submeter toda a cápsula em cortes que contenham tumor, cápsula e parênquima, com cerca de 0,5 cm de largura por 0,3 cm de espessura, como no esquema abaixo:
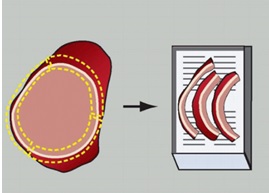
Fonte: Nikiforov Y. Diagnostic Pathology and Molecular Genetics of the Thyroid. 2009, Lippincott Williamns & Wilkins
Ainda sobre os nódulos encapsulados, alguns estudos mostram que há maior possibilidade de detecção de invasão capsular se forem feitos cortes seriados “de relação” nos dois polos da lesão, como no esquema abaixo:
- Tireoide normal, retirada em outros espécimes como laringectomia total: um cassete por cada terço de cada lobo, mais um para o istmo
- Doença oculta (metástase de carcinoma de tireoide sem primário identificável): incluir a totalidade do espécime
- Tireoidectomia profilática (NEM2): Idealmente toda a glândula deve ser submetida.
- Em caso de tireoidectomia parcial, incluir a margem ístmica.
IX.3 Exame microscópico
A patologia da tireoide apresenta inúmeros desafios, que são agravados pela heterogeneidade de abordagens em diferentes serviços. Talvez o maior deles seja a identificação de fatores de pior prognóstico, frequentemente subestimados, que elevam a estratificação de risco do paciente pelo esquema da Associação Americana de Tireoide (ATA), utilizado em muitos centros como guia de tratamento. É importante perceber que nem sempre os parâmetros da ATA são aqueles requeridos ou presentes nos laudos sinópticos dos principais diretrizes de patologia disponíveis, como é o caso do índice mitótico em carcinomas diferenciados, por exemplo. Abaixo, seguem alguns tópicos selecionados que comumente estão fora da visão do patologista generalista que lida com tumores tireoidianos em sua rotina e merecem atenção:
Microcarcinoma papilífero. De acordo com a classificação de tumores da OMS, 2022, microcarcinoma papilífero da tireoide não deve ser considerado um subtipo específico, já que se refere a uma definição de tamanho (1,0 cm) e não a um subtipo histológico. A nova classificação requer a especificação do subtipo (“Microcarcinoma papilífero clássico” ou “Microcarcinoma papilífero, subtipo de células altas”, por exemplo) já que, embora a maioria desses tumores tenha bom prognóstico, o curso clínico será definido pelo próprio subtipo histológico e demais características como multifocalidade, invasão linfo-vascular, perfil molecular, entre outros.
Identificação de subtipos agressivos do carcinoma papilífero da tireoide. Os subtipos de células altas, Hobnail e células colunares do carcinoma papilífero da tireoide tem curso clínico mais agressivo e precisam ser reconhecidos morfologicamente. A despeito do percentual mínimo necessário para classificar um carcinoma papilífero em um destes subtipos, é recomendável que sempre sejam relatados padrões citoarquiteturais de subtipos agressivos, se presentes, em qualquer percentagem (“carcinoma papilífero da tireoide clássico, com 20% do subtipo Hobnail”, por exemplo). Esta conduta ajuda a equipe assistente, em conjunto com outros dados
clínicos, a planejar o acompanhamento e decidir sobre a realização de radioiodoterapia.
Carcinomas de derivação folicular de alto grau. A contagem de mitoses e a procura por focos de necrose devem ser realizadas em todos os carcinomas tireoidianos. Carcinomas papilíferos, foliculares ou oncocíticos com 5 mitoses/2mm2 ou necrose, devem ser classificados de acordo com o seu subtipo, acrescentando a designação “alto grau” (por exemplo, “carcinoma papilífero clássico de alto grau”). Tumores de derivação folicular que apresentem qualquer proporção de áreas sólidas/trabeculares/insulares devem ser avaliados segundo os critérios de Turin para diagnóstico de carcinoma pouco diferenciado da tireoide, o qual deve ser relatado em percentagem em relação à área tumoral total (por exemplo “carcinoma papilífero da tireoide clássico com progressão para carcinoma pouco diferenciado da tireoide em 20% do tumor). Veja abaixo os critérios de Turin:
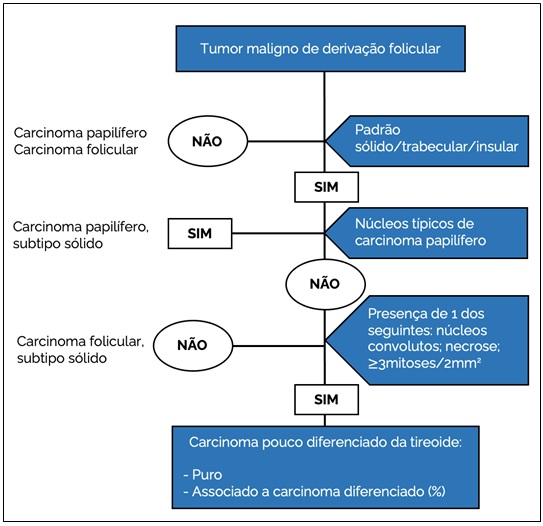
Disseminação intraparenquimatosa (intratireoidiana). Não raramente, o carcinoma papilífero da tireoide apresenta disseminação linfática pelo parênquima tireoidiano, representado não por êmbolos vasculares bem definidos, mas por calcificações psamomatosas à distância do tumor ou pequenos focos tumorais, estes últimos levando ao diagnóstico errôneo de multifocalidade tumoral. A distinção entre multifocalidade e disseminação intratireoidiana pode ser complicada, mas em geral, a presença de mais de 10 focos pequenos (por vezes submilimétricos), dispostos em padrão radial em torno do tumor e mais escassos quanto mais distantes dele (padrão “faning-out”), sem fibrose ou infiltrado inflamatório associados, favorecem disseminação e não multifocalidade. Este tipo de disseminação também é mais frequente em tumores ístmicos, já que a drenagem linfática da tireoide ocorre do istmo em direção aos lobos laterais.
Extensão extratireoidiana. A tireoide não é um órgão perfeitamente encapsulado, sendo possível encontrar tecido adiposo em seu parênquima, bem como ilhas de tecido tireoidiano no tecido fibroadiposo adjacente. A dificuldade e a subjetividade em definir a situação chamada de “extensão extratireoidiana mínima” (extensão microscópica), contribuiu para que só a extensão extratireoidiana macroscópica com comprometimento de músculo esquelético passasse a ser considerada para elevação da categoria pT do estadiamento (pT3b). Entretanto, até o presente momento, as diretrizes da ATA ainda fazem distinção entre extensão extratireoidiana microscópica (ATA-risco intermediário) e macroscópica (ATA-alto risco), o que quer dizer que ainda é necessário identificar a extensão extratireoidiana microscópica na prática diária. A presença de tumor em meio a tecido adiposo, além do limite dos últimos folículos normais e próximo a vasos e nervos de maior calibre, associados a reação estromal, podem ser úteis para definição de extensão microscópica em casos difíceis. Vale acrescentar, dentro de uma visão crítica do esquema atual da AJCC, deve-se atentar para os casos em que há extenso comprometimento de tecidos moles, multifocal, detectado à microscopia, mas que pela determinação atual do pTNM são enquadrados na categoria pT1. Tais casos devem ser discutidos em sessões multidisciplinares, no entendimento de que há extensão extratireoidiana, por definição, macroscópica e que a atribuição final pT1 provavelmente corresponde a um subestadiamento.
O estudo de margens. O estudo de margens ainda é um requisito do exame de peças retiradas para o tratamento de tumores malignos da tireoide e está presente nas recomendações da Associação Americana de Tireoide (ATA), sendo os tumores com margens comprometidas geralmente considerados de risco intermediário ou alto. Dessa forma, a informação do status das margens será requerida por cirurgiões, endocrinologistas e pela medicina nuclear para tomada de decisões terapêuticas. De maneira diversa de outros órgãos ocos (vísceras), em que a secção origina margens verdadeiras, na tireoide o conceito de “margem” é mais subjetivo. A margem, então, será a superfície externa da glândula/espécime que é pintada pelo patologista. Há uma série de fatores que influenciam a avaliação da superfície pintada, mas talvez a presença de artefatos de eletrocautério seja o mais crítico deles, capaz de tornar uma margem não avaliável a depender de sua intensidade. O debate sobre margens em tireoide ainda persiste entre especialistas, alguns trabalhos mostrando que a margem coincidente apenas ao exame microscópico nem sempre se correlaciona com a excisão incompleta do tumor e maior risco de recorrência. Dependendo da abordagem da equipe multidisciplinar de cada centro, por vezes é recomendável documentar a extensão em mm da margem coincidente, correlacionando com os achados cirúrgicos, uma vez que, a tendência comum é aceitar que tumores que não atingem o tecido pertireoidiano macroscopicamente e são claramente isolados pelos planos cirúrgicos (margem cirúrgica macroscopicamente livre) provavelmente não requerem conduta adicional, em contraste com os tumores que foram claramente seccionados (cirurgia r2).
Invasão vascular. Critérios rígidos para definição de invasão vascular em lesões foliculares encapsuladas devem ser observados: 1) os vasos devem estar na cápsula ou fora do tumor; 2) as células tumorais devem estar aderidas à parede do vaso, revestidas por endotélio e 3) opcionalmente (obrigatoriamente para alguns autores), deve haver um trombo de fibrina associado.
Invasão capsular. Excluindo-se o carcinoma papilífero, há consenso de que o diagnóstico de carcinoma folicular requer a presença de invasão capsular ou vascular da cápsula. Para a definição de invasão capsular, que é um tanto subjetiva em muitos casos, é necessária a transposição completa da cápsula pelo tumor ou a presença de nódulo tumoral satélite além da cápsula. Situações indefinidas, mesmo após recortes seriados, devem enquadrar a lesão na categoria de tumores foliculares de potencial de malignidade incerto.
IX.4 Estudo imuno-histoquímico. A imuno-histoquímica avançou nos últimos anos na patologia de tireoide, com múltiplas aplicações, e sua descrição detalhada foge ao escopo deste manual. Algumas aplicações se destacam:
Definição de origem tireoidiana. Marcadores já conhecidos, como TTF-1, tireoglobulina e PAX-8, quando usados em conjunto, ajudam a definir origem folicular tireoidiana de tumores primários e metastáticos. Neste contexto, cautela deve ser tomada na interpretação da tireoglobulina, que apresenta frequentemente reação de fundo. De maneira análoga, o PAX8, que muitas vezes é o único marcador positivo em carcinomas anaplásicos, apresenta reatividade cruzada com PAX5 e, portanto, pode ser positivo em linfomas B de alto grau, quando se está diante de uma neoplasia maligna indiferenciada ainda não classificada.
Diferencial de lesões foliculares difíceis. O HBME-1 parece ser o melhor marcador para definição de malignidade em lesões de padrão folicular, usado com ou sem associação ao CD56 e ao CK19. Deve-se observar que, só a marcação de membrana completa e na totalidade das células para HBME-1 deve ser valorizada, em conjunto com a perda do CD56 e positividade difusa para CK19, já que muitas lesões benignas podem ser positivas para os 3 marcadores em padrões variados. De qualquer modo, a imuno-histoquímica, isoladamente, não deve ser o fator decisivo para a classificação final, mas sim como ferramenta auxiliar.
Anticorpos substitutos de alterações genéticas. Nas situações em que o estudo molecular não é factível, o anticorpo BRAF (clone VE1) pode ser utilizado, com boa performance, não só em carcinomas, mas como complemento no diagnóstico de NIFTP (a positividade praticamente exclui este diagnóstico). A perda de marcação de PTEN e SDHB pode ser estudada em adenomas foliculares e carcinomas, no contexto da Síndrome PTEN-Hamartoma e da síndrome de Cowden/Cowden-like PTEN-selvagem, respectivamente, especialmente em pacientes jovens com tumores múltiplos, com ou sem história familiar.
Padrões específicos. A marcação de membrana peculiar pelo Ki67(MIB-1) no tumor trabecular hialinizante, a positividade de citoplasma e nuclear aberrante para Beta-catenina no carcinoma morular-cribriforme e a positividade difusa para CDX2 no subtipo colunar do carcinoma papilífero são exemplos de padrões específicos úteis em situações diagnósticas do dia-a-dia.
IX.5 Patologia molecular. As vias moleculares dos tumores tireoidianos hoje são conhecidas em maior detalhe e, com esta evolução, mais alterações genéticas acionáveis estão ao alcance do médico assistente no tratamento de tumores agressivos, refratários e/ou metastáticos não curados com a abordagem inicial.
Via MAPK. Os tumores de derivação folicular comumente estão relacionados com a via MAPK. As mutações desta via, quando presentes, são mutualmente exclusivas e se correlacionam com o tipo histológico do tumor. A mutação BRAF V600E talvez seja a mais importante no carcinoma papilífero e é encontrada com alta frequência em subtipos agressivos (70% do células altas e 90% do Hobnail). Mutações de RAS (especialmente NRAS), por sua vez, são vistas em tumores foliculares benignos (nódulos adenomatoides e adenomas), NIFTP (raros casos tem mutação BRAF K601E) e malignos (carcinoma folicular).
Fusões de RET. Ocorrem no carcinoma papilífero de tireoide com frequência geográfica variável, sendo as mais bem caracterizadas RET/PTC1 e RET/PTC3. É comum em tumores relacionados à exposição à radiação (incluindo vítimas de acidentes nucleares) e em até 30% do subtipo esclerosante difuso do carcinoma papilífero.
TERT. Mutações do promotor-TERT, geralmente associadas a mutações RAS/RAF, conferem maior risco de agressividade e estão relacionadas a evolução para carcinoma pouco diferenciado e carcinoma anaplásico. O achado de mutação de TERT em uma amostra de exame de triagem (como PAAF), pode ser suficiente para indicação de tireoidectomia total.
NTRK. Fusões de NTRK (principalmente NTRK1 e 3) são observadas em até 5% dos pacientes com câncer de tireoide e parecem se correlacionar com um padrão de crescimento multinodular e características histológicas de agressividade. Em pacientes com doença refratária/metastática em que outras alterações acionáveis não foram encontradas, a fusão de NTRK deve ser pesquisada como possível alvo terapêutico.
Bibliografia
WHO Classification of Tumours Editorial Board. Endocrine and Neuroendocrine tumours. Lyon (France): International Agency for Research on Cancer; 2022. (WHO classification of tumours series, 5th ed.; vol. 8). https://publications.iarc.fr/610
Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association Management Guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: the American Thyroid Association Guidelines task force on thy- roid nodules and differentiated thyroid cancer. Thyroid. 2016;26:1–133.
American Joint Committee on Cancer (AJCC). Cancer staging manual. In: Amin MB, Edge SB, Greene FL, et al, eds. AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer; 2017
College of American Pathologists. Protocol for the Examination of Specimens From Patients With Carcinomas of the Thyroid Gland. Version: 4.3.0.0. CAP; 2021.
Chan JKC. Tumors of the thyroid and parathyroid glands. In: Fletcher CDM (ed.). Diagnostic histopathology of tumors. 5. ed. London: Churchill Livingstone, 2019.
Udelsman R et al. Randomized prospective evaluation of frozen-section analysis for follicular neoplasms of the thyroid. Annals of Surgery, 2001. 233, n.5, 716-722)
Johson DN, Sadow PM. Exploration of BRAFV600E as a diagnostic adjuvant in the non-invasive follicular thyroid neoplasm with papillary-like nuclear features (NIFTP). Human Pathology (2018) 82, 32–38
Nikiforov Y. Diagnostic Pathology and Molecular Genetics of the Thyroid. 2009, Lippincott Williamns & Wilkins.
Volante, M., Collini, P., Nikiforov, Y. E., Sakamoto, A., Kakudo, K., Katoh, R., … Rosai, J. (2007). Poorly Differentiated Thyroid Carcinoma: The Turin Proposal for the Use of Uniform Diagnostic Criteria and an Algorithmic Diagnostic Approach. The American Journal of Surgical Pathology, 31(8), 1256–1264.
Haisheng F et al. Diffuse intrathyroidal dissemination of papillary thyroid carcinoma with no stromal fibrosis at presentation: A pattern of aggressive differentiated thyroid carcinoma. Pathol Res Pract. 2021 Aug;224:153510.
Pancer J et al. A thyroid gland with over 30 foci of papillary thyroid carcinoma with activating BRAF V600E mutation. Endocrinol Diabetes Metab Case Rep. 2019; 2019: 19-0006
Hye-Seon Oh et al. Modified Transverse-Vertical Gross Examination: a Better Method for the Detection of Definite Capsular Invasion in Encapsulated Follicular-Patterned Thyroid Neoplasms. Endocrine Pathology volume 30, pages106–112(2019)
Livolsi VA, Baloch ZW. On pathology reports of thyroid cancer specimens: what should the clinician expect? Thyroid 2012; 22(6):563-5.
Coca-Pelaz A et al. Papillary Thyroid Cancer—Aggressive Variants and Impact on Management: A Narrative Review. Adv Ther (2020) 37:3112–3128
Sanabria A et al. Microscopically positive surgical margins and local recurrence in thyroid cancer. A meta-analysis. g Oncol. 2019 Aug;45(8):1310-1316
Sanabria A et al. Microscopic positive surgical margins in thyroid carcinoma: a proposal for thyroid oncology teams. Langenbecks Arch Surg. 2021 May;406(3):563-569
Baloch Z et al. Immunohistochemical Biomarkers in Thyroid Pathology. Endocr Pathol 2018 Jun;29(2):91-112
LiVolsi VA, Baloch ZW. Use and Abuse of Frozen Section in the Diagnosis of Follicular Thyroid Lesions. Endocr Pathol. Winter 2005;16(4):285-93
Gasparri P, Roncati L. Paired Box Gene 8 (Pax8) Is also an Immunomarker of B-Cell Lineage Which Can Be Source of Diagnostic Pitfalls. am Med J. 2019 Jan;55(1):70-72
Prera-Hernandez JC. Molecular Pathology of Thyroid Tumors: Old Problems and New Concepts. urg Pathol Clin. 2021 Sep;14(3):493-506
Joung JY et al. Diffuse sclerosing variant of papillary thyroid carcinoma: major genetic alterations and prognostic implications. Histopathology 2016, 69, 45–53.
Chu-YH et al. Clinicopathologic and molecular characterization of NTRK– rearranged thyroid carcinoma (NRTC). Mod Pathol. 2020 November ; 33(11): 2186–2197
Voltar para a página inicial do manual