Liliana de Angelo Andrade
Renata De Marchi Triglia
Códigos de topografia
C53 Neoplasia maligna do colo útero, sem outras especificações (SOE)
CD53.0 Endocérvix
CD53.1 Ectocérvix
CD53.8 Lesão invasiva do colo do útero
CD53.9 Colo do útero, não especificado
I. Identificação e resumo clínico
II. Dados clínicos relevantes
II.1 Estudo citológico
- Não realizado
- Diagnóstico ________________ Data ___ /___ /___
II.2 Estudo biomolecular (pesquisa para Papilomavírus humano [HPV])
- Não realizado
- Sim (especificar) ___________
II.3 Tratamento prévio
- Não
- Sim (especificar) ___________
II.4 Colo tumoral
- Não
- Sim
II.5 Hidronefrose
II.6 Exclusão renal
III. Procedimento cirúrgico
III.1 Biópsia
III.2 Cone por alça (Leep)
III.3 Cone por alça (Leep) acompanhado de fragmento de reforço de canal endocervical
III.4 Cone a frio
III.5 Amputação de colo
III.6 Histerectomia simples
III.7 Histerectomia associada a
- Salpingectomia bilateral
- Salpingectomia direita
- Salpingectomia esquerda
- Ooforectomia bilateral
- Ooforectomia direita
- Ooforectomia esquerda
- Exenteração pélvica
- Outro (especificar procedimento) ________________
IV. Exame macroscópico
IV.1 Exame macroscópico do cone de colo do útero
O espécime mais comum em patologia cervical é a peça de conização, tanto por alça como a frio. O exame de todo o cone é fundamental para definir o diagnóstico e para orientar a conduta do cirurgião, podendo ser o tratamento definitivo.
IV.1.1 Fixação do espécime
IV.1.2 Dimensões do espécime: medidas do cone ___ x ___ cm de base e ____ cm de altura
IV.1.3 Peso do espécime ____ g
IV.1.4 Forma do espécime __________________
Nota: Se houver mais um fragmento correspondente ao reforço de canal, deve ser medido e orientado quanto à topografia das margens (cranial ou distal).
IV.1.5 Tumor
- Não identificável macroscopicamente
- Único
- Múltiplos
- Maior dimensão ____ cm
- Padrão
- Ulcerado
- Plano
- Exofítico
- Outro (especificar) ___________
IV.1.6 Processamento macroscópico do cone
Existem várias formas de processamento da peça de conização. Alguns são recebidos fechados e outros abertos ou estendidos. Frequentemente estão marcados com fio cirúrgico há 12 horas, para orientação da secção.
Antes de cortar a peça, as margens endocervicais e ectocervicais devem ser pintadas em cores diferentes (p. ex., margem endocervical pintada com tinta nanquim azul e margem ectocervical com tinta preta).
IV.1.6.1. Corte do cone em secções radiais
É o método mais comum, partindo do orifício externo ou do centro do cone e cortando em fragmentos radiais, orientados de acordo com os ponteiros do relógio. A espessura de cada fragmento é de cerca de 3 mm e cada cone resulta em 12 fragmentos, em média. Os fragmentos podem ser agrupados em quatro quadrantes, como os do relógio (Q1, Q2, Q3, Q4), o que facilita a correlação das imagens colposcópicas com o diagnóstico histológico (Figura 1).
IV.1.6.2. Corte do cone em secções paralelas
Pode ser feito quando a peça é recebida a fresco e marcada com fio às 12 horas, local em que será cortado e aberto. O espécime deve ser estendido e as pontas fixadas com alfinetes em uma superfície plana, como uma lâmina de cortiça ou papelão (Figura 2). Deixar a peça fixando em solução de formalina, com a superfície endocervical voltada para cima, por pelo menos 3 horas antes de recortar. Depois de fixado, pintar as margens de ressecção endocervical e ectocervical em cores diferentes, e fazer os cortes paralelos no sentido anteroposterior, de tal forma que toda a mucosa seja representada. Quando o cone é recebido já fixado, é mais difícil estendê-lo para esse tipo de corte.
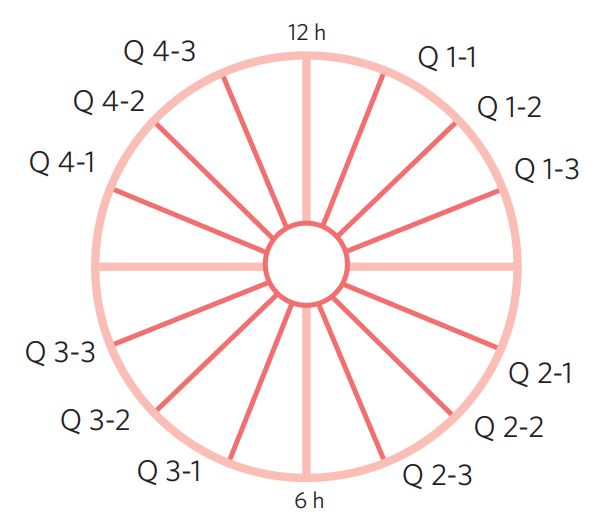
Figura 1 Recorte radial do cone: espécime é dividido em quatro quadrantes (Q1, Q2, Q3, Q4), como o mostrador de um relógio.
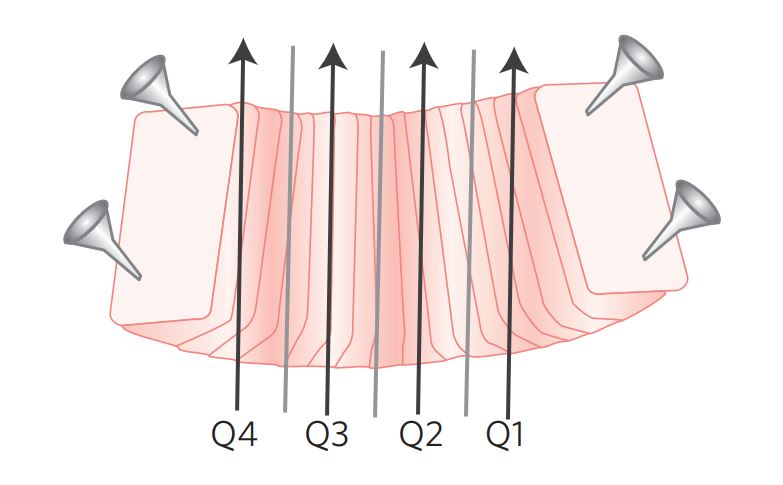
Figura 2: Recortes paralelos do cone: a peça é aberta às 12 h, estendida e fixada com alfinetes em superfície plana.
IV.1.6.3. Cones fragmentados: Os cones por alça podem ser enviados fragmentados, o que dificulta a avaliação das margens. Os fragmentos devem ser examinados com cuidado na tentativa de fornecer a melhor informação possível; porém, devem ficar registradas na descrição macroscópica as dificuldades encontradas no reconhecimento das margens.
IV.2 Exame macroscópico de histerectomia por neoplasia de colo do útero
IV.2.1 Medidas do espécime ___ x ___ x ___ cm
IV.2.2 Manguito vaginal mede ____ cm
IV.2.3 Peso (histerectomia) ____ g
IV.2.4 Forma do colo _________________________
IV.2.5 Tumor
- Não identificável macroscopicamente
- Único
- Múltiplos
- Maior dimensão ____ cm
- Padrão
- Ulcerado
- Plano
- Exofítico
- Outro (especificar) _____________
IV.2.6 Medidas do tumor ___ x ___ x ___ cm
IV.2.7 Profundidade máxima de invasão à macroscopia ____ mm
IV.2.8 Localização do tumor
- Esquerda
- Direita
- Anterior
- Posterior
- Ectocérvix
- Endocérvix
- Junção escamocolunar (JEC)
- Lesão polipoide
IV.2.9 Margem de ressecção macroscopicamente livre
IV.2.10 Distância do tumor à margem mais próxima _____ mm
IV.2.11 Margem de ressecção macroscopicamente comprometida pelo tumor
IV.2.12 Extensão do tumor a outras estruturas
- Útero
- Istmo
- Endométrio
- Miométrio
- Terço proximal da vagina
- Terço distal da vagina
- Paramétrio direito
- Paramétrio esquerdo
IV.2.13 Gânglios linfáticos (LN) enviados em grupos separados conforme as cadeias
- Não identificados macroscopicamente
- Paracervical direita e esquerda: número de LN _____; medidas dos LN: o maior mede ____ cm; o menor mede ____ cm
- Parametrial direita e esquerda: número de LN _____; medidas dos LN: o maior mede ____ cm; o menor mede ____ cm
- Obturadora direita e esquerda: número de LN _____; medidas dos LN: o maior mede ____ cm; o menor mede ____ cm
- Ilíaca interna direita e esquerda: número de LN _____; medidas dos LN: o maior mede ____ cm; o menor mede ____ cm
- Ilíaca externa direita e esquerda: número de LN _____; medidas dos LN: o maior mede ____ cm; o menor mede ____cm
- Ilíaca comum direita e esquerda: número de LN _____; medidas dos LN: o maior mede ____ cm; o menor mede ____ cm
- Pré-sacral: número de LN _____; medidas dos LN: o maior mede ____ cm; o menor mede ____ cm
- Sacral: número de LN _____; medidas dos LN: o maior mede ____ cm; o menor mede ____ cm
- Outra (especificar) _____________; medidas dos LN __________
IV.2.14 Processamento macroscópico da histerectomia
A histerectomia por carcinoma de colo do útero pode incluir o segmento superior da vagina ou o manguito vaginal.
Antes de recortar a peça, deve-se pintar com tinta nanquim a margem de ressecção ectocervical ou o manguito vaginal, se for o caso. Toda a margem de ressecção deve ser estudada histologicamente.
Retirar os paramétrios direito e esquerdo, identificando-os e incluindo-os na totalidade.
Se o diagnóstico anterior à histerectomia foi neoplasia intraepitelial cervical (NIC) ou carcinoma microinvasor, não deve existir lesão tumoral macroscopicamente visível no colo do útero e, portanto, todo o colo deve ser encaminhado para o exame histológico. Deve ser feita a amputação do colo e a ressecção de toda a peça, de maneira semelhante à realizada na conização.
Se existir lesão tumoral visível no colo do útero, esta deve ser medida nos maiores eixos e amostrado um ou mais fragmentos dessa área em toda a espessura para exame microscópico. Além disso, devem ser representados um fragmento de cada quadrante do colo, um fragmento da transição colo-corpo do útero (istmo), um do endométrio e fragmentos de outras alterações concomitantes.
V. Exame microscópico
V.1 Tipo histológico
V.1.1 Neoplasia escamosa
- Lesão Intraepitelial Escamosa Cervical (NIC)
- Lesão intraepitelial escamosa de baixo grau/ Neoplasia Intraepitelial Cervical grau 1 (NIC 1 ou displasia leve, sendo que o termo displasia leve atualmente é pouco usado)
- Lesão intraepitelial escamosa de alto grau/ Neoplasia Intraepitelial Cervical grau 2 (NIC 2 ou displasia moderada, sendo que o termo displasia moderada atualmente é pouco usado)
- Lesão intraepitelial escamosa de alto grau/ Neoplasia Intraepitelial Cervical grau 3/carcinoma in situ (NIC 3 ou displasia grave, sendo que o termo displasia grave atualmente é pouco usado)
- Carcinoma escamoso com invasão inicial ou microinvasor do estádio da FIGO Ia1 ou Ia2 (com a medida da profundidade máxima de invasão)
- Carcinoma escamoso, SOE
- Queratinizante
- Não queratinizante
- Basaloide
- Condilomatoso (do inglês warty)
- Verrucoso
- Papilífero
- Tipo linfoepitelioma
- Escamo-transicional (ou escamoso papilífero)
V.1.2 Neoplasia glandular
- Adenocarcinoma in situ
- Adenocarcinoma com invasão superficial ou microinvasor, nos estádios
FIGO Ia1 ou Ia2 (com medidas de profundidade máxima de invasão) - Adenocarcinoma
- Endocervical usual
- Mucinoso, SOE:
– tipo gástrico (com amplo espectro morfológico)
– tipo intestinal
– tipo células em anel de sinete
- Viloglandular
- Adenocarcinoma endometrioide
- Adenocarcinoma de células claras
- Adenocarcinoma seroso
- Adenocarcinoma mesonéfrico
- Adenocarcinoma associado a carcinoma neuroendócrino
V.1.3 Outros tumores epiteliais
- Carcinoma adenoescamoso
- Variante glassy-cell
- Carcinoma adenoide cístico
- Carcinoma adenoide basal
- Carcinoma Indiferenciado
- Tumores neuroendócrinos
- De Baixo grau
- Tumor carcinoide
- Tumor carcinoide atípico
- Carcinoma Neuroendócrino de alto grau
- Carcinoma neuroendócrino de pequenas células
- Carcinoma neuroendócrino de grandes células
V.2 Grau histológico
Não há um consenso da literatura quanto às normas para a classificação do grau histológico do carcinoma escamoso, porém são recomendados 3 graus: bem, moderado e pouco diferenciados, baseando-se na extensão da diferenciação escamosa, em associação ao grau de atipia nuclear.
V.2.1 Para os carcinomas escamosos invasivos (classificação sugerida) OMS
- GX – O carcinoma não pode ser graduado
- G1 – Carcinoma bem diferenciado
- G2 – Carcinoma moderadamente diferenciado
- G3 – Carcinoma pouco diferenciado
V.2.2 Para os adenocarcinomas, a classificação sugerida leva em conta a arquitetura do tumor (áreas glandulares, papilíferas e sólidas) e os aspectos nucleares
- G1 – Adenocarcinoma com pequeno componente de padrão sólido (até 5% da neoplasia) e atipia nuclear leve a moderada
- G2 – Adenocarcinoma moderadamente diferenciado, quando até 50% da neoplasia tem padrão sólido
- G3 – Adenocarcinoma pouco diferenciado, com padrão sólido predominante (mais de 50% da neoplasia), com intensa atipia nuclear
Nota: Tumores sem diferenciação são classificados pela Organização Mundial da Saúde (OMS) como carcinomas indiferenciados.
V.3 Outras alterações na peça cirúrgica
- Ausência de neoplasia residual
- Alterações actínicas
- Outra(s) (especificar) _______________
V.4 Profundidade de invasão
Distância entre a superfície e a margem profunda do tumor ____ mm
V.5 Invasão vascular
- Ausente
- Presente
- Não avaliável
V.6 Número de gânglios linfáticos acometidos entre os dissecados em cada cadeia _______________
VI. Diagnóstico final (exemplos de laudos)
VI.1 Produto de conização
Carcinoma epidermóide superficialmente invasivo ou microinvasivo (WHO, 2014), estádio Ia1, com profundidade máxima de invasão de 2 mm. Presença de lesão intraepitelial cervical de alto grau (NIC 2 e 3) associada. Ausência de invasão angiolinfática. Margens cirúrgicas da ressecção da ectocérvice e da endocérvice livres de comprometimento neoplásico.
Nota importante: a partir do novo estádio da FIGO (Bhatla N et al, 2019) nos carcinomas com invasão estromal inicial, ou micro-invasão, a medida exigida é apenas a profundidade máxima de invasão, não sendo mais necessária a medida de extensão lateral da lesão, como existia na edição anterior do estádio da FIGO. O laudo da peça de conização deve conter o diagnóstico da lesão principal, as lesões associadas, a medida de profundidade máxima do carcinoma em mm, no fragmento em que a lesão for maior. Os êmbolos carcinomatosos são descritos como presentes, ausentes ou não determinados; a descrição das margens cirúrgicas da ectocérvice e da endocérvice podem ser categorizadas como: (a) indeterminadas (por artefatos com o cautério ou falta de epitélio); (b) livres de atipias; (c) comprometidas com lesões descritas como: NIC 1, NIC 2, NIC 3, carcinoma; (d) exíguas ou próximas, relatando-se a medida da distância da lesão à margem de ressecção em mm. Descrever também as lesões do material do reforço de canal, se for o caso.
VI.2 Produto de histerectomia
Carcinoma epidermoide moderadamente diferenciado (grau histológico 2) do colo uterino, com 8 mm de profundidade máxima de invasão cervical. Extensão da neoplasia para o terço proximal da vagina e parede miometrial à direita. Presença de múltiplos focos de invasão angiolinfática. Margens cirúrgicas de ressecção livres de comprometimento neoplásico. Ausência de metástase em 9 linfonodos dissecados.
Estádio patológico: pT3a, N0 (pTNM). Estádio FIGO: IIIA.
Nota importante
- O laudo da histerectomia deve conter, além dos dados semelhantes à peça de conização, a quantidade total de linfonodos ressecados e a quantidade de linfonodos comprometidos por metástase. Se o tumor invade o corpo do útero, deve ser feito o diagnóstico diferencial entre carcinoma primário do colo ou do corpo do útero.
VII. Estádios TNM e FIGO
Pelo sistema de estádio TNM, sob a sigla pTMN, a letra T refere-se ao tumor primário, não tratado, e a letra p significa classificação patológica, baseada nas descrições macroscópica e microscópica da lesão. A designação cTNM corresponde à classificação clínica do tumor, antes da cirurgia, ou quando a classificação patológica não for possível.
O código pN refere-se aos linfonodos removidos para a avaliação de metástases; pM sempre implica exame histológico de lesões a distância para comprovação de metástases.
VII.1 Estádio clínico dos carcinomas de colo do útero
VII.1.1 Tumores primários (pT) – sistema de estádio pTNM e FIGO (Bhatla et al, 2019 ****)
Tabela 1 Estádio clínico dos tumores primários do colo uterino.
| pTNM | FIGO | Descrição |
| pTX | (–) | O tumor primário não pode ser avaliado |
| pT0 | (–) | Não há evidência de tumor primário |
| pTis | (–) | Carcinoma in situ (lesão precursora) |
| pT1 | I | Tumor confinado ao colo do útero |
| pT1a | IA | Carcinoma superficialmente invasivo ou microinvasivo, diagnosticado somente pelo exame microscópio. Não deve haver lesão tumoral macroscópica. São conceituadas as medidas de profundidade máxima de invasão estromal < 5 mm (medida a partir da base do epitélio) * |
| pT1a1 | IA1 | Profundidade máxima de invasão estromal menor que 3 mm (<3,0 mm). Invasão vascular não afeta a classificação **. |
| pT1a2 | IA2 | Profundidade máxima de invasão estromal ≥ 3 mm e < 5 mm. Invasão vascular não afeta a classificação **. |
| pT1b | IB | Lesão clinicamente visível restrita ao colo do útero, com invasão ≥ 5 mm |
| IB1 | Maior dimensão da lesão < 2 cm | |
| IB2 | Maior dimensão da lesão ≥ 2 cm e < 4 cm em sua maior dimensão | |
| IB3 | Lesão ≥ 4 cm em sua maior dimensão | |
| pT2 | II | Carcinoma invasor além do útero sem comprometimento da parede pélvica ou do terço inferior da vagina |
| pT2a | IIA | Tumor sem invasão dos paramétrios |
| pT2a1 | IIA1 | Lesão clinicamente visível medindo < 4 cm em sua maior dimensão |
| pT2a2 | IIA2 | Lesão clinicamente visível ≥ 4 cm em sua maior dimensão |
| pT2b | IIB | Tumor com invasão parametrial, sem invasão da parede pélvica |
| pT3 | III | O tumor se estende à parede pélvica e/ou envolve o terço inferior da vagina e/ou causa hidronefrose ou rim não funcionante |
| pT3a | IIIA | O tumor envolve o terço inferior da vagina, sem extensão para a parede pélvica |
| pT3b | IIIB | O tumor se estende à parede pélvica e/ou causa hidronefrose ou rim não funcionante |
| IIIC | Envolvimento da parede pélvica e/ou linfonodos para-aórticos, sem restrição do tamanho tumoral | |
| IIIC1 | Apenas metástase para linfonodos pélvicos | |
| IIIC2 | Metástase para linfonodos para-aórticos | |
| pT4 | IVA | O tumor invade órgãos pélvicos adjacentes: mucosa da bexiga ou do reto e/ou se estende além da pelve verdadeira*** |
| M1 | IVB | Metástases à distância |
* Nota 1: Toda lesão visível macroscopicamente, mesmo que com invasão superficial, deve ser considerada como pT1b/estádio 1B.
** Nota 2: Nos carcinomas superficialmente invasivos ou micro-invasivos, a profundidade da invasão dos carcinomas escamosos é medida da membrana basal do epitélio até o ponto mais profundo de invasão no estroma. A atual classificação da FIGO não faz diferença no conceito de micro-invasão para os carcinomas escamosos ou adenocarcinomas. No entanto, nos adenocarcinomas endocervicais, a micro-invasão é mais difícil de ser avaliada e, de forma prática, a espessura de toda a lesão é medida para obter o valor da profundidade máxima de invasão (mede-se a partir da membrana basal do epitélio de superfície até o ponto mais profundo da invasão). Pela classificação da FIGO, a presença de êmbolos carcinomatosos, venosos ou linfáticos, não altera o estádio Ia, mas deve ser sempre relatada no laudo.
*** Nota 3: A presença de edema bolhoso não é evidência suficiente para a classificação do tumor como estádio IV. A lesão deve ser confirmada por biópsia.
**** Nota 4: Houve revisão no estádio da FIGO em 2018 para colo uterino, sendo que estas alterações serão incorporadas em edições futuras do TNM/AJCC
VII.1.2 Linfonodos regionais (pN*) – sistema de estádio pTNM
- pNX – Os linfonodos regionais não podem ser avaliados
- pN0 – Ausência de metástase nos linfonodos regionais
- pN0(i+) – Células tumorais isoladas em linfonodos regionais < 0,2mm
- pN1 – Presença de metástase nos linfonodos regionais
* Nota: Os linfonodos regionais incluem os gânglios linfáticos: paracervical, parametrial, obturador (ou hipogástrico); ilíacos comum, interno e externo; pré-sacral e sacral. As metástases para outros linfonodos não regionais são classificadas como metástase à distância.
VII.1.3 Metástases à distância (pM) – sistema de estádio pTNM
- M0 – Ausência de metástase
- M1 – Metástase à distância (incluindo disseminação peritoneal, envolvimento de linfonodos supraclaviculares, mediastinais, para-aórticos ou linfonodos distantes; metástases pulmonares, hepáticas ou ósseas)*
* Nota: Os tumores com metástases à distância são classificados pela FIGO como estádio IVB.
VIII. Considerações gerais
O carcinoma de colo do útero é o segundo tipo mais comum de câncer em mulheres no mundo. A infecção pelo HPV, por via sexual, é o fator etiológico mais importante no desenvolvimento deste carcinoma. Os dois tipos histológicos mais frequentes do colo do útero são o carcinoma escamoso (80%) seguido pelo adenocarcinoma.
Para os adenocarcinomas do tipo usual, um consórcio internacional de patologistas ginecológicos desenvolveu recentemente um sistema de classificação de risco para metástase linfonodal e comportamento mais agressivo (Diaz de Vivar et al, 2013). Esta classificação de risco é baseada na morfologia e descreve 3 padrões:
– Padrão A: glândulas bem demarcadas, sem padrão destrutivo de invasão. Ausência de invasão vascular; ausência de crescimento sólido. Tem comportamento clínico indolente e faz diagnóstico diferencial com adenocarcinoma in situ, com risco próximo de 0% para metástase linfonodal.
– Padrão B: padrão destrutivo focal em um adenocarcinoma de padrão A; células isoladas ou pequenos grupos celulares invadem o estroma; ausência de crescimento sólido. Invasão vascular pode estar presente. O risco de metástase linfonodal é de 4%.
– Padrão C: invasão estromal destrutiva difusa; padrão confluente, sólido, cribriforme; invasão vascular pode estar presente. O risco de metástase linfonodal é de 23%.
Deve-se salientar que em 20% dos casos de adenocarcinoma in situ, existem dificuldades em avaliar se há invasão inicial. Este sistema de padrões vem auxiliar, classificando tais lesões como adenocarcinoma de padrão A, sem invasão destrutiva. Por outro lado, não há correspondência entre o padrão de invasão e o tamanho do tumor e, adenocarcinomas muito pequenos podem ter padrão C de invasão. Com isso, pretende-se selecionar modalidades de tratamento, diferentes e mais adequadas, evitando-se tratamento excessivo e complicações desnecessárias. Como é um sistema novo, segundo a literatura, a reprodutibilidade diagnóstica entre os patologistas ainda é moderada (κ=0,65) e tem sido indicado como um diagnóstico complementar, associado às medidas da lesão (Parra-Herran C et al, 2016).
VIII.1 Estudo imuno-histoquímico
O diagnóstico do carcinoma escamoso normalmente é feito somente com base na morfologia; entretanto, nos casos pouco diferenciados, pode-se realizar o exame imuno-histoquímico. Nessa situação, o marcador mais indicado é a proteína P63 (p63), que tem expressão forte, em padrão difuso, em cerca de 97% dos carcinomas escamosos e é negativa nos adenocarcinomas.
Outro marcador imuno-histoquímico importante é o p16 (INK4a), estudado por Sano et al. (1998), que demonstraram expressão intensa e difusa da proteína p16 (INK4a) em todas as lesões intraepiteliais escamosas de alto grau, com infecção com os subtipos de HPV de alto risco (16, 18, 31, 33, 52 e 58), bem como em todos os carcinomas escamosos e na maioria dos adenocarcinomas do colo do útero. As lesões associadas com HPV de baixo risco (6 e 11), incluindo condiloma acuminado e NIC1, demonstraram imunorreação fraca e focal para o p16 (INK4a). A expressão do p16 para ser considerada positiva deve ser forte em “em bloco”, e não em pequenos agrupamentos celulares.
VIII.2 Patologia molecular
O HPV é vírus da família Papillomaviridae, englobando cerca de 200 tipos diferentes que são classificados em baixo e alto risco para o câncer. Os principais HPV de alto risco, com maior probabilidade de provocar lesões persistentes e associadas às lesões pré-cancerosas, são os tipos 16, 18, 31, 33, 45 e 58. Os HPV dos tipos 6 e 11 são considerados de baixo risco oncogênico, sendo frequentemente encontrados nas verrugas genitais. A identificação do HPV é muito importante nos estudos sobre a oncogênese no colo do útero, visto que em mais de 90% dos carcinomas escamosos e na maioria dos adenocarcinomas existe a infecção crônica pelo vírus. A pesquisa do HPV nas lesões, assim como sua tipagem, pode ser realizada por exames laboratoriais de diagnóstico molecular, como o teste de captura híbrida e o PCR.
Recentemente, um grupo internacional de patologistas ginecológicos fez uma revisão de casos de adenocarcinomas do colo uterino (“International Endocervical Adenocarcinoma Criteria and Classification”- IECC; Stolnicu, 2018) e propôs uma classificação alternativa em relação à classificação dos adenocarcinomas pela OMS, de 2014. Esta nova proposta de classificação tem base em características morfológicas, no perfil imuno-histoquímico e em métodos para a detecção do HPV. Assim, a IECC divide os adenocarcinomas endocervicais em: 1) associados ao HPV (tipo mais comum, representado principalmente pelo adenocarcinoma do tipo usual) e 2) não associados ao HPV (sendo o adenocarcinoma do tipo gástrico o tipo histológico mais comum). Os métodos de detecção do HPV foram por hibridização in situ e pela expressão da p16, através da reação imuno-histoquímica. A hibridização in situ do HPV de alto risco teve maior sensibilidade e especificidade que a expressão do p16. Foram observadas diferenças no comportamento clínico destes dois grupos de adenocarcinoma, sendo que os adenocarcinomas não relacionados ao HPV geralmente se associam a pior prognóstico. Muito provavelmente, estes novos estudos levarão a futuras modificações na próxima edição da classificação da OMS.
IV. Bibliografia:
1.Bhatla N, Berek JS, Fredes MC et al. Revised FIGO staging for carcinoma of the cervix uteri. Int J Gynecol Obstet 2019: 145: 129-135.
2. Diaz de Vivar A, Roma AA, Park KJ. Invasive endocervical adenocarcinoma: proposal for a new pattern-based classification system with significant clinical implications: a multi-institutional study. Int J Gynecol Pathol 2013; 32(6): 592-601.
3.McCluggage WG. Endocervical glandular lesions: controversial aspects and ancillary techniques. J Clin Pathol 2003; 56:164-73.
4.Parra-Herran C, Taljaard M, Djordjevic B et al. Pattern-based classification of invasive endocervical adenocarcinoma, depth of invasion measurement and distinction from adenocarcinoma in situ: interobserver variation among gynecologic pathologists. Mod Pathol 2016; 29(8): 879-92.
5.Rosai J. Appendix D – Standardized surgical pathology reporting for major tumor types. In: Rosai J (ed.). Rosai and Ackerman’s surgical pathology. Philadelphia: Mosby, 2011. p.2574-77.
6.Sano T, Oyama T, Kashiwabara K, Fukuda T, Nakajima T. Expression status of p16 protein is associated with human papillomavirus oncogenic potential in cervical and genital lesions. Am J Pathol 1998; 153(6):1741-8.
7.Stolnicu S, Barsan I, Hoang L, et al. International Endocervical Adenocarcinoma Criteria and Classification (IECC): a new pathogenetic classification for invasive adenocarcinomas of the endocervix. Am J Surg Pathol. 2018;42:214–226.
8. Talia KL, McCluggage WG. The developing spectrum of gastric-type cervical glandular lesions. Pathology 2018; 50(2): 122-133.
9.Kurman RJ, Carcangiu ML,Herrington CS, Young RH (eds.). World Health Organization classification of tumours of Female Reproductive Organs. Lyon: IARC, 2014.
10.Zheng W, Robboy S. Cervical squamous cell carcinoma. In: Robboy SJ (ed.). Robboy’s pathology of the female reproductive tract. London: Churchill Livingstone, 2009.
Voltar para a página inicial do manual